
Struttura, proprietà e usi dell'acido idroiodico (HI)

Il acido idroiodico È una soluzione acquosa di acido iodidrico che si caratterizza per la sua elevata acidità. Una definizione più vicina alla terminologia chimica e IUPAC è che si tratta di un idracido, la cui formula chimica è HI.
Tuttavia, per differenziarlo dalle molecole di ioduro di idrogeno gassoso, HI (g) è indicato come HI (aq). È per questo motivo che nelle equazioni chimiche è importante identificare il mezzo o la fase fisica in cui si trovano i reagenti e i prodotti. Anche così, la confusione tra acido iodidrico e acido idroiodico è comune..
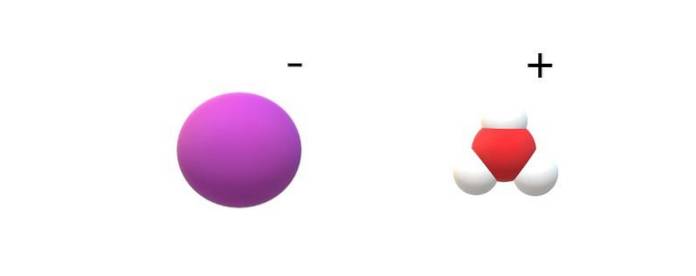
Se si osservano le molecole impegnate nella loro identità, si troveranno notevoli differenze tra HI (g) e HI (ac). In HI (g), c'è un legame H-I; mentre in HI (ac), sono in realtà una coppia ionica I- e H.3O+ interagendo elettrostaticamente (immagine in alto).
D'altra parte, HI (ac) è una fonte di HI (g), poiché il primo viene preparato sciogliendo il secondo in acqua. Per questo motivo, a meno che non si trovi in un'equazione chimica, HI può essere utilizzato anche per riferirsi all'acido idroiodico. HI è un forte agente riducente e un'ottima fonte di ioni I.- in mezzo acquoso.
Indice articolo
- 1 Struttura dell'acido idroiodico
- 2 Proprietà
- 2.1 Descrizione fisica
- 2.2 Massa molecolare
- 2.3 Odore
- 2.4 Densità
- 2.5 Punto di ebollizione
- 2.6 pKa
- 2.7 Acidità
- 2.8 Agente riducente
- 3 Nomenclatura
- 4 Usi
- 4.1 Fonte di iodio in sintesi organiche e inorganiche
- 4.2 Agente riducente
- 4.3 Processo Cativa
- 4.4 Sintesi illecite
- 5 Riferimenti
Struttura dell'acido idroiodico
L'acido idroiodico, come appena spiegato, è costituito da una soluzione di HI in acqua. Essendo in acqua, le molecole di HI si dissociano completamente (elettrolita forte), dando origine agli ioni I.- e H.3O+. Questa dissociazione può essere rappresentata dalla seguente equazione chimica:
HI (g) + HDueO (l) => I-(ac) + H3O+(AC)
Cosa sarebbe equivalente se fosse scritto come:
HI (g) + HDueO (l) => HI (ac)
Tuttavia, HI (ac) non rivela affatto cosa sia successo alle molecole gassose di HI; indica solo che si trovano in un mezzo acquoso.
Pertanto, la vera struttura di HI (ac) è costituita dagli ioni I- e H.3O+ circondato da molecole d'acqua che le idratano; più è concentrato l'acido idroiodico, minore è il numero di molecole d'acqua non protonate.
Commercialmente, infatti, la concentrazione di HI è dal 48 al 57% in acqua; più concentrato equivarrebbe ad avere acido troppo fumante (e anche più pericoloso).
Nell'immagine si può vedere che l'anione I- è rappresentato da una sfera viola e H3O+ con sfere bianche e una rossa, per l'atomo di ossigeno. Il catione H3O+ presenta la geometria molecolare della piramide trigonale (vista da un piano più alto nell'immagine).
Proprietà
Descrizione fisica
Liquido incolore; ma può esibire toni giallastri e marroni se è a diretto contatto con l'ossigeno. Questo perché gli ioni I- finiscono per ossidarsi a iodio molecolare, IDue. Se c'è molto ioDue, è più che probabile che si formi l'anione triioduro, I3-, che colora la soluzione marrone.
Massa molecolare
127,91 g / mol.
Odore
Acre.
Densità
La densità è 1,70 g / mL per la soluzione HI al 57%; poiché, le densità variano a seconda delle diverse concentrazioni di HI. A questa concentrazione si forma un azeotropo (distillato come singola sostanza e non come miscela) alla cui relativa stabilità può essere dovuta la sua commercializzazione rispetto ad altre soluzioni..
Punto di ebollizione
L'azeotropo HI 57% bolle a 127 ° C a una pressione di 1,03 bar (VAI A ATM).
pKa
-1.78.
Acidità
È un acido estremamente forte, tanto da essere corrosivo per tutti i metalli e tessuti; anche per le gomme.
Questo perché il legame H-I è molto debole e si rompe facilmente durante la ionizzazione in acqua. Inoltre, i legami idrogeno I- - HOHDue+ sono deboli, quindi non c'è nulla che possa interferire con l'H3O+ reagire con altri composti; cioè, l'H3O+ è stato "libero", come l'io- ciò non attira con troppa forza il suo contrasto.
Agente riducente
HI è un potente agente riducente, il cui principale prodotto di reazione è I.Due.
Nomenclatura
La nomenclatura dell'acido idroiodico deriva dal fatto che lo iodio "lavora" con un unico stato di ossidazione: -1. Inoltre, lo stesso nome indica che ha l'acqua nella sua formula strutturale [I-] [H3O+]. Questo è il suo unico nome, poiché non è un composto puro ma una soluzione.
Applicazioni
Fonte di iodio in sintesi organiche e inorganiche
HI è un'ottima fonte di ioni I- per sintesi inorganiche e organiche ed è anche un potente agente riducente. Ad esempio, la sua soluzione acquosa al 57% viene utilizzata per la sintesi di ioduri alchilici (come CH3CHDueI) da alcoli primari. Allo stesso modo, un gruppo OH può essere sostituito da un I in una struttura.
Agente riducente
L'acido idroiodico è stato utilizzato per ridurre, ad esempio, i carboidrati. Se il glucosio disciolto in questo acido viene riscaldato, perderà tutti i suoi gruppi OH, ottenendo l'idrocarburo n-esano come prodotto..
Allo stesso modo, è stato utilizzato per ridurre i gruppi funzionali dei fogli di grafene, in modo tale da poter essere funzionalizzati per dispositivi elettronici..
Processo Cativa

Passi
Il processo inizia (1) con il complesso organo-iridio [Ir (CO)DueioDue]-, geometria del piano quadrato. Questo composto "riceve" metil ioduro, CH3I, prodotto di acidificazione di CH3OH con il 57% di HI. In questa reazione si produce anche acqua e grazie ad essa si ottiene finalmente acido acetico, consentendo il recupero dell'HI nell'ultimo passaggio..
In questo passaggio sia il gruppo -CH3 come -I si legano al centro metallico dell'iridio (2), formando un complesso ottaedrico con una sfaccettatura composta da tre ligandi I. Uno degli iodi finisce per essere sostituito da una molecola di monossido di carbonio, CO; e ora (3), il complesso ottaedrico ha una sfaccettatura composta da tre ligandi CO.
Quindi si verifica un riarrangiamento: il gruppo -CH3 si "allenta" da Ir e si lega all'adiacente CO (4) per formare un gruppo acetile, -COCH3. Questo gruppo viene rilasciato dal complesso dell'iridio per legarsi agli ioni ioduro e dare CH3COI, acetil ioduro. Qui viene recuperato il catalizzatore di iridio, pronto per partecipare a un altro ciclo catalitico.
Infine, il CH3Il CIO subisce una sostituzione dell'I- per una molecola di HDueO, il cui meccanismo finisce per rilasciare HI e acido acetico.
Sintesi illecite

Si può vedere che prima si verifica una sostituzione del gruppo OH con I, seguita da una seconda sostituzione con H.
Riferimenti
- Wikipedia. (2019). Acido idroiodico. Estratto da: en.wikipedia.org
- Andrews, Natalie. (24 aprile 2017). Gli usi dell'acido idriodico. Scienza. Estratto da: sciencing.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Acido idriodico. Estratto da: alfa.com
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Acido idriodico. Database PubChem., CID = 24841. Estratto da: pubchem.ncbi.nlm.nih.gov
- Steven A. Hardinger. (2017). Glossario illustrato di chimica organica: acido idroiodico. Estratto da: chem.ucla.edu
- Reusch William. (5 maggio 2013). Carboidrati. Recupero da: 2.chemistry.msu.edu
- In Kyu Moon, Junghyun Lee, Rodney S. Ruoff e Hyoyoung Lee. (2010). Ossido di grafene ridotto mediante grafitizzazione chimica. DOI: 10.1038 / ncomms1067.


Nessun utente ha ancora commentato questo articolo.