
Struttura, proprietà, nomenclatura, usi dell'acido solforoso
Il acido solforoso è un ossacido che si forma per dissoluzione dell'anidride solforosa, SODue, in acqua. È un acido inorganico debole e instabile, che non è stato rilevato in soluzione, poiché la reazione della sua formazione è reversibile e l'acido si decompone rapidamente nei reagenti che lo hanno prodotto (SODue e H.DueO).
La molecola di acido solforoso è stata finora rilevata solo in fase gassosa. Le basi coniugate di questo acido sono anioni comuni nelle forme di solfiti e bisolfiti..
SWDue + HDueO <=> HSO3- + H+
Ciò indica che utilizzando lo spettro Raman non è possibile rilevare la presenza di acido solforoso in una soluzione di anidride solforosa in acqua..
Quando esposto all'atmosfera, si trasforma rapidamente in acido solforico. L'acido solforoso viene ridotto a idrogeno solforato dall'azione di acido solforico diluito e zinco.
Il tentativo di concentrare una soluzione OSDue evaporando l'acqua per ottenere acido solforoso privo di acqua, non ha prodotto risultati, poiché l'acido si decompone rapidamente (invertendo la reazione di formazione), quindi l'acido non può essere isolato.
Indice articolo
- 1 Formazione naturale
- 2 Struttura
- 2.1 Molecola isolata
- 2.2 Molecola circondata dall'acqua
- 2.3 SO2 ∙ nH2O
- 3 Proprietà fisiche e chimiche
- 3.1 Formula molecolare
- 3.2 Peso molecolare
- 3.3 Aspetto fisico
- 3.4 Densità
- 3.5 Densità del vapore
- 3.6 Corrosività
- 3.7 Solubilità in acqua
- 3.8 Sensibilità
- 3.9 Stabilità
- 3.10 costante di acidità (Ka)
- 3.11 pKa
- 3.12 pH
- 3.13 Punto di infiammabilità
- 3.14 Decomposizione
- 4 Nomenclatura
- 5 Sintesi
- 6 Usi
- 6.1 Nel bosco
- 6.2 Disinfezione e agente sbiancante
- 6.3 Agente conservante
- 6.4 Altri usi
- 7 Riferimenti
Formazione naturale
L'acido solforoso si forma in natura dalla combinazione di anidride solforosa, un prodotto dell'attività di grandi fabbriche, con l'acqua atmosferica. Per questo motivo è considerato un prodotto intermedio delle piogge acide, provocando gravi danni all'agricoltura e all'ambiente..
La sua forma acida non è utilizzabile in natura, ma viene solitamente preparata nei suoi sali, solfiti e bisolfiti di sodio e potassio..
Il solfito viene generato in modo endogeno nel corpo come risultato del metabolismo degli amminoacidi contenenti zolfo. Allo stesso modo, il solfito viene prodotto come prodotto della fermentazione di cibi e bevande. Il solfito è allergenico, neurotossico e metabolico. Viene metabolizzato dall'enzima solfito ossidasi che lo converte in solfato, un composto innocuo.
Struttura
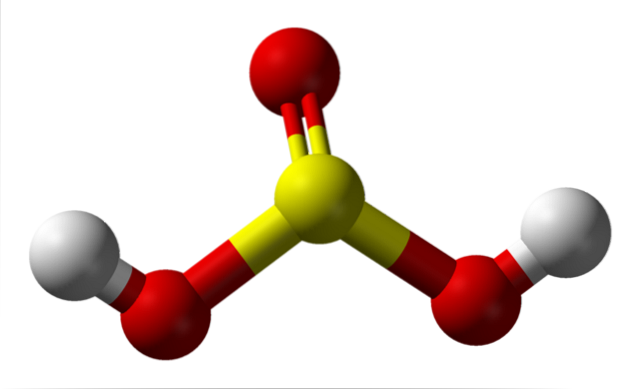
Molecola isolata
Nell'immagine è possibile vedere la struttura di una molecola isolata di acido solforoso allo stato gassoso. La sfera gialla al centro corrisponde all'atomo di zolfo, quelle rosse agli atomi di ossigeno e quelle bianche agli idrogeni. La sua geometria molecolare attorno all'atomo S è una piramide trigonale, con gli atomi di O che disegnano la base.
Quindi, allo stato gassoso, le molecole di H.DueSW3 possono essere pensate come minuscole piramidi trigonali che fluttuano nell'aria, supponendo che sia abbastanza stabile da durare per un po 'senza reagire.
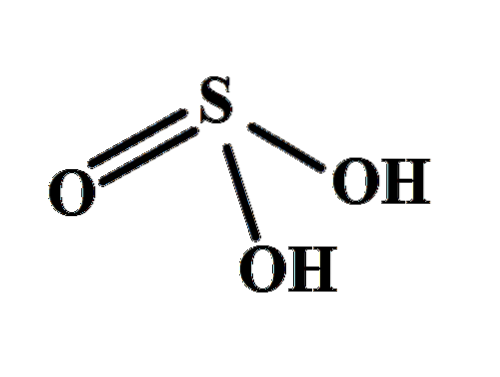
La struttura rende chiaro da dove provengono i due idrogeni acidi: dai gruppi idrossilici legati allo zolfo, HO-SO-OH. Pertanto, per questo composto, non è corretto presumere che uno dei protoni acidi, H.+, viene rilasciato dall'atomo di zolfo, H-SODue(OH).
I due gruppi OH consentono all'acido solforoso di interagire attraverso legami idrogeno e inoltre, l'ossigeno del legame S = O è un accettore di idrogeno, che converte HDueSW3 sia un buon donatore che accettatore di questi ponti.
Secondo quanto sopra, l'HDueSW3 dovrebbe essere in grado di condensare in un liquido, proprio come fa l'acido solforico, H.DueSW4. Tuttavia, non è così che accade.
Molecola circondata dall'acqua
Ad oggi non è stato possibile ottenere acido solforoso anidro, cioè H.DueSW3(l); mentre l'HDueSW4(ac), invece, dopo la disidratazione, si trasforma nella sua forma anidra, H.DueSW4(l), che è un liquido denso e viscoso.
Se si presume che la molecola di HDueSW3 rimane invariato, quindi potrà dissolversi in larga misura in acqua. Le interazioni che governerebbero in dette soluzioni acquose sarebbero ancora legami idrogeno; Tuttavia, le interazioni elettrostatiche esisterebbero anche come risultato dell'equilibrio di idrolisi:
HDueSW3(ac) + HDueO (l) <=> HSO3-(ac) + H3O+(AC)
HSO3-(ac) + HDueO (l) <=> SW3Due-(ac) + H3O+
Lo ione solfito, SO3Due- Sarebbe la stessa molecola di cui sopra, ma senza le sfere bianche; e lo ione idrogeno solforato (o bisolfito), HSO3-, conserva una sfera bianca. Infinità di sali possono derivare da entrambi gli anioni, alcuni più instabili di altri.
In realtà, è stato confermato che una porzione estremamente piccola delle soluzioni è costituita da H.DueSW3; cioè, la molecola spiegata non è quella che interagisce direttamente con le molecole d'acqua. La ragione di ciò è perché subisce la decomposizione che causa SODue e H.DueOppure, che è termodinamicamente favorito.
SWDue∙nHDueO
La vera struttura dell'acido solforoso è costituita da una molecola di anidride solforosa circondata da una sfera d'acqua composta da n molecole..
Pertanto, il SODue, la cui struttura è angolare (tipo boomerang), insieme alla sua sfera acquosa, è responsabile dei protoni acidi che caratterizzano l'acidità:
SWDue∙ nHDueO (ac) + HDueO (l) <=> H3O+(ac) + HSO3-(ac) + nHDueO (l)
HSO3-(ac) + HDueO (l) <=> SW3Due-(ac) + H3O+
Oltre a questo equilibrio, c'è anche un equilibrio di solubilità per SODue, la cui molecola può sfuggire dall'acqua alla fase gassosa:
SWDue(g) <=> SWDue(AC)
Proprietà fisiche e chimiche
Formula molecolare
HDueSW3
Peso molecolare
82,073 g / mol.
Aspetto fisico
È un liquido incolore, con un odore pungente di zolfo.
Densità
1,03 g / ml.
Densità del vapore
2.3 (in relazione all'aria presa come 1)
Corrosività
È corrosivo per metalli e tessuti.
Solubilità dell'acqua
Miscibile con acqua.
Sensibilità
È sensibile all'aria.
Stabilità
Stabile, ma incompatibile con basi forti.
Costante di acidità (Ka)
1,54 x 10-Due
pKa
1.81
pH
1.5 sulla scala del pH.
punto di accensione
Non infiammabile.
Decomposizione
Quando riscaldato, l'acido solforoso può decomporsi, emettendo fumo tossico di ossido di zolfo..
Nomenclatura
Lo zolfo ha le seguenti valenze: ± 2, +4 e +6. Dalla formula HDueSW3, si può calcolare il numero di valenza o ossidazione dello zolfo nel composto. Per fare ciò, basta risolvere una somma algebrica:
2 (+1) + 1v + 3 (-2) = 0
Essendo un composto neutro, la somma delle cariche degli atomi che lo costituiscono deve essere 0. Risolvendo per v per l'equazione precedente, abbiamo:
v = (6-2) / 1
Quindi, v è uguale a +4. Cioè, lo zolfo partecipa con la sua seconda valenza e, secondo la nomenclatura tradizionale, al nome deve essere aggiunto il suffisso -oso. Per questo motivo in HDueSW3 è noto come acido solforicoorso.
Un altro modo più veloce per determinare questa valenza è confrontando l'HDueSW3 con l'HDueSW4. Nella HDueSW4 lo zolfo ha una valenza di +6, quindi se viene rimosso un O, la valenza scende a +4; e se ne viene rimosso un altro, la valenza scende a +2 (che sarebbe il caso dell'acido singhiozzozolfoorso, HDueSWDue).
Sebbene meno noto, all'HDueSW3 Può anche essere chiamato acido trioxosulfuric (IV), secondo la nomenclatura stock.
Sintesi
Tecnicamente si forma bruciando zolfo per formare anidride solforosa. Questo poi si dissolve in acqua per formare acido solforoso. Tuttavia, la reazione è reversibile e l'acido si decompone rapidamente nei reagenti..
Questa è una spiegazione del perché l'acido solforoso non si trova in soluzione acquosa (come già accennato nella sezione sulla sua struttura chimica).
Applicazioni

In generale, gli usi e le applicazioni dell'acido solforico, poiché la sua presenza non è rilevabile, si riferiscono agli usi e alle applicazioni delle soluzioni di anidride solforosa e delle basi e dei sali dell'acido..
Nel bosco
Nel processo al solfito, la polpa di legno viene prodotta sotto forma di fibre di cellulosa quasi pure. Vari sali di acido solforoso vengono utilizzati per estrarre la lignina dai trucioli di legno, utilizzando recipienti ad alta pressione chiamati digistors..
I sali utilizzati nel processo di ottenimento della polpa del legno sono i solfiti (SO3Due-) o bisolfito (HSO3-), a seconda del pH. Il controione può essere Na+, ACDue+, K+ o NH4+.
Agente disinfettante e sbiancante
-L'acido solforoso è usato come disinfettante. Viene anche usato come agente sbiancante delicato, soprattutto per materiali sensibili al cloro. Inoltre, è usato come sbiancamento dei denti e additivo alimentare.
-È un ingrediente in vari cosmetici per la cura della pelle ed è stato utilizzato come elemento pesticida nell'eliminazione dei ratti. Elimina le macchie causate dal vino o dalla frutta su diversi tessuti.
-Serve come antisettico, essendo efficace nella prevenzione delle infezioni della pelle. In alcuni momenti, è stato utilizzato nelle fumigazioni per disinfettare navi, effetti personali di malati vittime di epidemie, ecc..
Agente conservante
L'acido solforoso viene utilizzato come conservante per frutta e verdura e per prevenire la fermentazione di bevande come vino e birra, essendo un elemento antiossidante, antibatterico e fungicida..
Altri usi
-L'acido solforoso è utilizzato nella sintesi di farmaci e sostanze chimiche; nella produzione di vino e birra; raffinazione di prodotti petroliferi; ed è usato come reagente analitico.
-Il bisolfito reagisce con i nucleosidi pirimidinici e si aggiunge al doppio legame tra la posizione 5 e 6 della pirimidina, modificando il legame. La trasformazione del bisolfito viene utilizzata per testare strutture secondarie o superiori di polinucleotidi.
Riferimenti
- Wikipedia. (2018). Acido solforoso. Estratto da: en.wikipedia.org
- Nomenclatura degli acidi. [PDF]. Estratto da: 2.chemistry.gatech.edu
- Voegele F. Andreas & col. (2002). Informazioni sulla stabilità dell'acido solforoso (H.DueSW3) e il suo dimero. Chem. Eur. J. 2002. 8, No.24.
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione., P. 393). Mc Graw Hill.
- Calvo Flores F. G. (s.f.). Formulazione chimica inorganica. [PDF]. Recupero da: ugr.es
- PubChem. (2018). Acido solforoso. Estratto da: pubchem.ncbi.nlm.nih.gov
- Steven S. Zumdahl. (15 agosto 2008). Ossiacido. Encyclopædia Britannica. Estratto da: britannica.com



Nessun utente ha ancora commentato questo articolo.