
Struttura, proprietà, sintesi, usi dell'acido solfammico

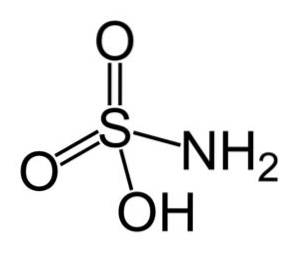
Il acido solfammico è un composto inorganico formato da un atomo di zolfo (S) legato in modo covalente e da un legame singolo con un gruppo idrossile (-OH) e un gruppo amminico (-NHDue) e mediante doppio legame a due atomi di ossigeno (O). È un solido cristallino bianco. La sua formula chimica è NHDueSW3H. Conosciuto anche come acido aminosolfonico, acido amidosolfonico, acido amidosolforico e acido sulfamidico..
L'acido solfammico è un acido forte. Può reagire con metalli, ossidi metallici e carbonati. I suoi sali sono generalmente solubili in acqua, rendendolo un buon anticalcare nelle apparecchiature di processo. Viene spesso utilizzato negli zuccherifici per pulire le incrostazioni di carbonato nelle apparecchiature dell'evaporatore..
L'acido solfammico è un riduttore di nitriti (NODue-) e questa proprietà chimica viene utilizzata in varie applicazioni, come nell'industria dei coloranti e nell'analisi dei nitriti..
Viene utilizzato nella concia delle pelli e nello sbiancamento della polpa per la fabbricazione della carta. In effetti, è un contaminante alimentare, come spesso si trova nelle carte e nel cartone utilizzati per imballare la spesa..
Viene anche utilizzato nell'elettrodeposizione dei metalli, come standard di laboratorio e uno dei suoi derivati è un erbicida molto efficace..
Indice articolo
- 1 Struttura
- 2 Nomenclatura
- 3 Proprietà
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Punto di fusione
- 3.4 Densità
- 3.5 Solubilità
- 3,6 pH
- 3.7 Costante di dissociazione
- 3.8 Proprietà chimiche
- 3.9 Altre proprietà
- 4 Sintesi
- 5 Usi
- 5.1 Nell'industria dei coloranti
- 5.2 Nella lavorazione della pelle
- 5.3 Nell'attrezzatura del processo di pulizia
- 5.4 Nella raffinazione dei metalli
- 5.5 Come reagente standard in laboratorio
- 5.6 Nell'analisi dei nitriti
- 5.7 Nell'analisi dell'ossigeno disciolto nell'acqua
- 5.8 Nella preparazione del protossido di azoto
- 5.9 In agricoltura
- 5.10 Su tessuti ignifughi
- 5.11 In varie applicazioni
- 6 Riferimenti
Struttura
L'acido solfammico cristallizza sotto forma di cristalli ortorombici dipiramidali. Forma prismi e fogli compatti durante la cristallizzazione dalla soluzione fredda, nonché fogli diamantati quando cristallizza dalla soluzione acquosa calda.
Nomenclatura
- Acido solfammico
- Acido aminosolfonico
- Acido amidosolfonico
- Acido amidosolforico
- Acido solfamidico
Proprietà
Stato fisico
Solido cristallino bianco.
Peso molecolare
97,1 g / mol.
Punto di fusione
205 ºC, si decompone a 209 ºC.
Densità
2,15 g / cm3
Solubilità
Solubile in acqua:
- 12,8% a 0 ºC
- 17,57% a 20 ºC
- 22,77% a 40 ºC
Leggermente solubile in metanolo, leggermente solubile in acetone, insolubile in etere.
Liberamente solubile in basi azotate e in solventi organici contenenti azoto.
Insolubile in disolfuro di carbonio (CSDue) e tetracloruro di carbonio (CCl4).
pH
0,41 (in soluzione 1 N, ovvero 1 equivalente / L).
Costante di dissociazione
0.101 a 25 ºC.
Proprietà chimiche
È un acido forte. Quasi quanto cloridrico (HCl), nitrico (HNO3) e solforico (H.DueSW4).
Le soluzioni acquose di acido solfammico sono altamente ionizzate. Il suo pH è inferiore alle soluzioni di acido formico, fosforico e ossalico.
In acqua, l'acido solfammico perde solo il protone che è legato all'ossigeno. Gli idrogeni legati all'azoto si tengono saldamente uniti.
In soluzione acquosa si idrolizza lentamente per dare solfato di ammonio acido (NH4HSO4). È stabile in condizioni asciutte.
L'acido solfammico attacca metalli, ossidi metallici e carbonati per generare solfammati. Ad esempio, con il metallo potassio (K) forma solfammato di potassio (KOSODueNHDue) e idrogeno (HDue).
Tutti i sali dell'acido solfammico sono solubili in acqua. I sali di calcio, piombo e bario sono molto solubili in acqua, a differenza dei corrispondenti sali di acido solforico.
Acido nitroso (HNODue) reagisce quantitativamente con il gruppo amminico dell'acido solfammico, liberando azoto (NDue). Si stima che lo ione solfamato funzioni in questa reazione come un'ammide, non un'ammina..
L'acido solfammico viene ossidato da cloro, bromo o clorato di potassio per convertirlo in acido solforico. Questa reazione non si verifica con altri ossidanti come l'acido cromico o il permanganato di potassio..
Non è compatibile (reagisce) con alcali forti, cloro, acido ipocloroso, ipocloriti, cianuri e solfuri.
Altre proprietà
Non è igroscopico (questo significa che non assorbe umidità dall'aria).
Quando riscaldato fino alla decomposizione emette fumi altamente tossici di ossidi di zolfo e acido cloridrico (HCl).
Uno dei suoi derivati, il solfammato di ammonio, è un ritardante di fiamma.
È moderatamente tossico.
Sintesi
L'acido solfammico si ottiene facendo reagire l'urea CO (NHDue)Due con acido solforico fumante, cioè acido solforico (H.DueSW4) concentrato contenente anidride solforica (SO3).
Può anche essere sintetizzato facendo reagire acido clorosolfonico (HClO3Cl) e ammoniaca (NH3).
Applicazioni
Nell'industria della tintura
L'acido solfammico viene utilizzato per rimuovere i nitriti in eccesso in modo rapido ed efficace nelle reazioni di diazotizzazione nella sintesi dei coloranti. È molto più pratico dell'urea per questo scopo.
Nella lavorazione della pelle
Durante la concia delle pelli, l'uso di acido solfammico al posto dell'acido solforico fornisce una consistenza più fine e setosa.
Inoltre, poiché il solfammato di calcio è solubile in acqua, a differenza del solfato di calcio, l'acido solfammico può essere utilizzato nel processo di decalcificazione senza lasciare le macchie che a volte si verificano sulla pelle quando si utilizza acido solforico..

Nelle apparecchiature di processo di pulizia
L'acido solfammico viene utilizzato come detergente disincrostante in bollitori, reattori, tubi, sistemi di raffreddamento e scambiatori di calore.
In questa apparecchiatura, le incrostazioni sono formate dalla circolazione di acqua o composti di processo in centrali elettriche, impianti chimici, acciaierie, cartiere, stazioni di compressione e altre industrie..
I depositi di calcare o solidi possono essere organici (alghe, limo, funghi) o inorganici (ossidi di ferro, solfuri di ferro, carbonati di calcio o magnesio, solfati, fosfati o silicati).
L'acido solfammico è molto efficace se usato per rimuovere le incrostazioni di carbonato di calcio. Può essere utilizzato su apparecchiature in rame, ottone, acciaio inossidabile, ghisa e acciaio zincato.
Viene utilizzato sotto forma di una soluzione al 5-10% in peso. È particolarmente utilizzato negli zuccherifici per pulire evaporatori in ghisa con scambiatori di calore in rame.

Va utilizzato a temperature non superiori a 50-60 ºC. Temperature di 70 ºC portano alla formazione di solfati insolubili come CaSO4.
Quando viene utilizzato in combinazione con cloruro di sodio, si verifica un effetto sinergico e la soluzione consente all'ossido ferrico di dissolversi lentamente. In questo caso, non deve essere utilizzato con l'acciaio inossidabile perché viene rilasciato acido cloridrico, che può causare corrosione in questo materiale..
Nella raffinazione dei metalli
La galvanizzazione di metalli come rame, argento, cobalto, nichel, zinco, cadmio, ferro e piombo può essere eseguita con successo in soluzioni di acido solfammico. Questo può essere gestito molto più facilmente dell'acido fluorosilicico (H.DueSiF6).
Come reagente standard in laboratorio
Date alcune caratteristiche dell'acido solfammico quali: la sua forza come acido, la sua facilità di essere purificato mediante ricristallizzazione in acqua, la sua stabilità e la sua non igroscopicità, è stato utilizzato come standard primario a livello di laboratorio. Ciò significa che viene utilizzato per determinazioni quantitative di alcali..

Nell'analisi dei nitriti
A causa della sua facile reazione con i nitriti, l'acido solfammico viene utilizzato per determinarli in soluzione..
Nell'analisi dell'ossigeno disciolto in acqua
Poiché l'acido solfammico reagisce con i nitriti nell'acqua, viene rilasciato azoto, è possibile eseguire la determinazione dell'ossigeno disciolto nell'acqua, poiché viene eliminata l'interferenza causata dai nitriti..
Nella preparazione del protossido di azoto
L'acido solfammico reagisce con l'acido nitrico per generare protossido di azoto (NDueO). Questa reazione è più sicura di quella del nitrato di ammonio per ottenere questo gas.
In agricoltura
Un derivato dell'acido solfammico, il solfammato di ammonio, è un efficace erbicida non tossico per animali.
Si applica mediante rugiada sulle foglie della specie da rimuovere a fine estate o inizio autunno, preferibilmente con tempo umido. Mentre il composto viaggia dalle foglie alle radici, la pianta muore.

Un altro vantaggio di questo composto è che non sterilizza in modo permanente il terreno. In effetti, una parte dell'azoto del solfammato di ammonio sarà disponibile nel terreno per la crescita delle piante nella prossima stagione..
In tessuti ignifughi
La sua compatibilità con la cellulosa e le sue caratteristiche ignifughe fanno del solfammato di ammonio un agente per l'ottenimento di tessuti e carta ignifughi..
Viene utilizzato al 10% del peso del tessuto, il cui aspetto e la sensazione al tatto rimangono inalterati. Il tessuto in uso va lavato a secco, mai lavato con acqua per non sciogliere il solfammato.
È particolarmente utile nei sipari del teatro o in luoghi simili.

In varie applicazioni
Viene utilizzato come catalizzatore in alcune reazioni chimiche, come nella preparazione di resine urea-formaldeide. È anche utile come battericida e stabilizzante del cloro nelle piscine e come candeggina in pasta di legno nelle cartiere e nelle cartiere..
Riferimenti
- NOI. Biblioteca nazionale di medicina. (2019). Acido solfammico. Recupero da pubchem.ncbi.nlm.nih.gov
- Williams, D.L.H. (2004) Nitrosation at nitrogen center. Nelle reazioni di nitrosazione e nella chimica dell'ossido nitrico. Capitolo 2. Recupero da sciencedirect.com
- Clapp, Leallyn B. (1943). Acido solfammico e suoi usi. Chem. Educ. 1943, 20, 4, 189. Recuperato da pubs.acs.org
- McDonald, James. (2003). Acido solfammico. Recuperato da veoliawatertech.com
- Sastri, V.S. (2010). Gestione e controllo della corrosione. Nella corrosione di Shreir. Recupero da sciencedirect.com
- Pratima Bajpai. (2018). Argomenti vari. In Biermann's Handbook of Pulp and Paper. Terza edizione. Recupero da sciencedirect.com



Nessun utente ha ancora commentato questo articolo.