
Formula, proprietà, rischi e usi dell'acido propanoico

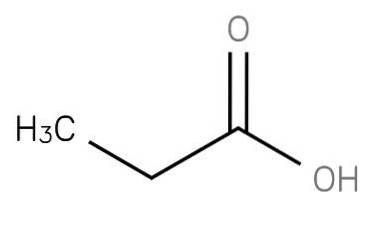
Il acido propanoico è un acido grasso saturo a catena corta comprendente etano attaccato al carbonio di un gruppo carbossilico. La sua formula è CH3-CHDue-COOH. L'anione CH3CH2COO così come i sali e gli esteri dell'acido propanoico sono noti come propionati (o propanoati).
Può essere ottenuto da residui di polpa di legno mediante processo di fermentazione utilizzando batteri del genere propionibacterium. Si ottiene anche da etanolo e monossido di carbonio utilizzando un catalizzatore di trifluoruro di boro (O'Neil, 2001).
Un altro modo per ottenere l'acido propanoico è l'ossidazione della propionaldeide in presenza di ioni cobalto o manganese. Questa reazione procede rapidamente a temperature fino a 40-50 ° C:
2CH3CHDueCHO + ODue → 2CH3CHDueCOOH
Il composto è naturalmente presente a bassi livelli nei prodotti lattiero-caseari ed è generalmente prodotto, insieme ad altri acidi grassi a catena corta, nel tratto gastrointestinale dell'uomo e di altri mammiferi come prodotto finale della digestione microbica dei carboidrati..
Ha una significativa attività fisiologica negli animali (Human Metabolome Database, 2017).
Indice articolo
- 1 Proprietà fisiche e chimiche
- 2 Reattività e pericoli
- 3 Biochimica
- 4 Usi
- 5 Riferimenti
Proprietà fisiche e chimiche
L'acido propanoico è un liquido oleoso incolore con un odore pungente, sgradevole e rancido. Il suo aspetto è mostrato nella figura 2 (National Center for Biotechnology Information, 2017).

L'acido propanoico ha un peso molecolare di 74,08 g / mol e una densità di 0,992 g / ml. I suoi punti di congelamento e ebollizione sono rispettivamente di -20,5 ° C e 141,1 ° C. L'acido propanoico è un acido debole il cui pKa è 4,88.
Il composto è molto solubile in acqua, potendo sciogliere 34,97 grammi di composto per ogni 100 ml di solvente. È anche solubile in etanolo, etere e cloroformio (Royal Society of Chemistry, 2015).
L'acido propanoico ha proprietà fisiche intermedie tra quelle degli acidi carbossilici più piccoli, degli acidi formico e acetico e degli acidi grassi più grandi..
Mostra le proprietà generali degli acidi carbossilici e può formare derivati di ammide, estere, anidride e cloruro. Può subire alfa-alogenazione con bromo in presenza di PBr3 come catalizzatore (la reazione HVZ) per formare CH3CHBrCOOH.
Reattività e rischi
L'acido propanoico è un materiale infiammabile e combustibile. Può essere infiammato da calore, scintille o fiamme. I vapori possono formare miscele esplosive con l'aria, potendo viaggiare verso la fonte di accensione ed esplodere.
La maggior parte dei vapori è più pesante dell'aria. Verranno sparsi lungo il terreno e raccolti in aree basse o ristrette (fognature, scantinati, serbatoi). Pericolo di esplosione del vapore all'interno, all'esterno o nelle fognature.
Le sostanze contrassegnate con una (P) possono polimerizzare in modo esplosivo se riscaldate o avvolte in un incendio. I contenitori possono esplodere se riscaldati (ACIDO PROPIONICO, 2016).
Il composto deve essere tenuto lontano da fonti di calore o di accensione. Quando riscaldato fino alla decomposizione, emette fumo acre e fumi irritanti.
L'acido propanoico è irritante per la pelle, gli occhi, il naso e la gola ma non produce effetti sistemici acuti e non ha potenziale genotossico dimostrabile. In caso di contatto, lavare abbondantemente con acqua (Scheda di sicurezza del materiale acido propionico, 2013).
Biochimica
La base coniugata dell'acido propanoico, propionato, si forma come il frammento terminale di tre atomi di carbonio (attivato con il coenzima A come propionil-CoA) nell'ossidazione degli acidi grassi del carbonio di numero dispari e nell'ossidazione della catena laterale del colesterolo.
Esperimenti con isotopi radioattivi del propionato iniettati in ratti a digiuno indicano che può apparire in glicogeno, glucosio, intermedi del ciclo dell'acido citrico, amminoacidi e proteine..
La via del metabolismo dell'acido propanoico coinvolge l'interazione con il coenzima A, la carbossilazione per formare il metilmalonil-coenzima A e la conversione in acido succinico, che entra nel ciclo dell'acido citrico.
L'acido propanoico può essere ossidato senza formare corpi chetonici e, a differenza dell'acido acetico, è incorporato in un carboidrato oltre che in un lipide (Bingham, Cohrssen e Powell, 2001).
L'aciduria propionica è una delle più comuni aciduria organica, una malattia che comprende molti disturbi diversi.
L'esito dei pazienti nati con aciduria propionica è scarso nei modelli di sviluppo intellettuale, con il 60% che ha un QI inferiore a 75 e richiede un'educazione speciale.
Il successo dei trapianti di fegato e / o rene in alcuni pazienti ha portato a una migliore qualità della vita ma non ha necessariamente prevenuto visceri e complicazioni neurologiche.
Questi risultati sottolineano la necessità di un monitoraggio metabolico permanente, indipendentemente dalla strategia terapeutica..
Applicazioni
L'acido propanoico inibisce la crescita di batteri e muffe a livelli compresi tra 0,1 e 1% in peso. Di conseguenza, la maggior parte dell'acido propanoico prodotto viene consumato come conservante sia per i mangimi che per gli alimenti per il consumo umano come cereali e cereali..
La conservazione di mangimi, cereali e alimenti oltre alla produzione di propionato di calcio e sodio, che rappresenta quasi l'80% del consumo globale di acido propanoico nel 2016, rispetto al 78,5% del 2012.
Circa il 51% del consumo globale di acido propanoico è destinato all'alimentazione animale e alla conservazione dei cereali, mentre quasi il 29% è utilizzato nella produzione di propionati di calcio e sodio, utilizzati anche nell'industria alimentare e dei mangimi.
Altri mercati importanti per l'acido propanoico sono la produzione di erbicidi e dietilchetoni. Le applicazioni di volume inferiore includono la produzione di propionato di acetato di cellulosa, prodotti farmaceutici, esteri di solventi, aromi e fragranze, plastificanti, coloranti per tessuti, cuoio e gomma e ausiliari.
La domanda di acido propanoico dipende fortemente dalla produzione di mangimi e cereali, seguita da alimenti confezionati e prodotti da forno.
Le prospettive di crescita globale per l'acido propanoico e i suoi sali nei mangimi / cereali e nella conservazione degli alimenti sono significative (IHS Markit, 2016).
Altri mercati in rapida crescita includono esteri propionato per solventi, come n-butile e pentil propionato; Questi esteri sono sempre più utilizzati come sostituti dei solventi elencati come inquinanti atmosferici pericolosi..
Riferimenti
- Bingham, E., Cohrssen, B. e Powell, C. (2001). Volumi di tossicologia di Patty 1-9 5a ed. New York: John Wiley & Sons.
- EMBL-EBI. (2016, 14 ottobre). acido propionico. Recupero da ChEBI: ebi.ac.uk.
- Database del metaboloma umano. (2017, 2 marzo). Acido propionico. Recupero da hmdb.ca: hmdb.ca.
- IHS Markit. (2016, dicembre). Manuale di chimica economica acido propionico. Recupero da ihs: ihs.com.
- Scheda di sicurezza del materiale Acido propionico. (2013, 21 maggio). Recupero da sciencelab: sciencelab.com.
- National Center for Biotechnology Information… (2017, 22 aprile). Database composto di PubChem; CID = 1032. Recupero da pubchem.ncbi.nlm.nih.gov.
- O'Neil, M. (. (2001). The Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals. 13a edizione. New Jersey: Merck and Co., Inc.
- ACIDO PROPIONICO. (2016). Estratto da cameochemicals: cameochemicals.noaa.gov.
- Royal Society of Chemistry. (2015). Acido propionico. Estratto da chemspider: chemspider.com.



Nessun utente ha ancora commentato questo articolo.