
Struttura chimica, proprietà, preparazione, usi dell'acido borico
Il acido borico è un composto inorganico la cui formula chimica è H.3BO3. È costituito da un solido bianco o incolore. È un acido debole che in soluzione acquosa produce, a seconda della sua concentrazione, un pH compreso tra 3,8 e 4,8. È scarsamente solubile in acqua fredda e moderatamente solubile in acqua calda..
L'acido borico fu scoperto nel 1702 da Wilhelm Homberg (1652-1713), che trattò il borace con acido solforico, ottenendo una soluzione ad azione medicinale che prese il nome di acqua sedativa di Homberg..

Tuttavia, si sottolinea anche che Homberg ha preparato l'acido borico aggiungendo acqua al borace e riscaldando la soluzione fino a farla evaporare, lasciando così i cristalli di acido borico nel sedimento..
Questo acido è un composto molto utile che ha numerose applicazioni nell'industria e nella medicina, essendo utilizzato anche come insetticida, preservante del legno, ritardante di fiamma ed è un costituente di una soluzione tampone di pH..
Indice articolo
- 1 Struttura chimica
- 1.1 Cristalli
- 2 Proprietà
- 2.1 Nomi
- 2.2 Massa molare
- 2.3 Aspetto fisico
- 2.4 Odore
- 2.5 Aroma
- 2.6 Punto di fusione
- 2.7 Punto di ebollizione
- 2.8 Solubilità in acqua
- 2.9 Solubilità in altri solventi
- 2.10 Coefficiente di ripartizione ottanolo / acqua
- 2.11 Acidità (pKa)
- 2.12 pH
- 2.13 Pressione di vapore
- 2.14 Stabilità
- 2.15 Decomposizione
- 2.16 Reattività
- 3 Preparazione
- 4 Usi
- 4.1 Nell'industria
- 4.2 In medicina
- 4.3 Insetticida
- 4.4 Conservazione
- 4,5 tampone pH
- 4.6 Reattori nucleari
- 4.7 Agricoltura
- 5 Controindicazioni
- 6 Riferimenti
Struttura chimica
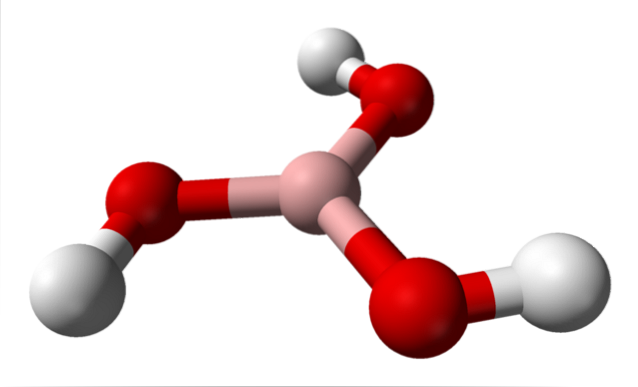
Nell'immagine in alto abbiamo la molecola stessa di H.3BO3. Si noti che gli atomi di idrogeno, rappresentati da sfere bianche, non sono legati all'atomo di boro centrale, come potrebbe suggerire la formula chimica; ma piuttosto, agli atomi di ossigeno, rappresentati da sfere rosse.
Pertanto, una formula più conveniente, sebbene meno utilizzata, per l'acido borico è B (OH)3, indicando che la sua acidità è dovuta agli ioni H.+ rilasciato dai loro gruppi OH. La molecola B (OH)3 ha una geometria del piano trigonale, con il suo atomo di boro che ha un'ibridazione chimica spDue.
La B (OH)3 È una molecola altamente covalente, poiché la differenza di elettronegatività tra l'atomo di boro e l'ossigeno non è molto grande; quindi i legami B-O sono essenzialmente covalenti. Si noti inoltre che la struttura di questa molecola assomiglia a quella di uno spinner. Può ruotare sul proprio asse allo stesso modo?
Cristalli
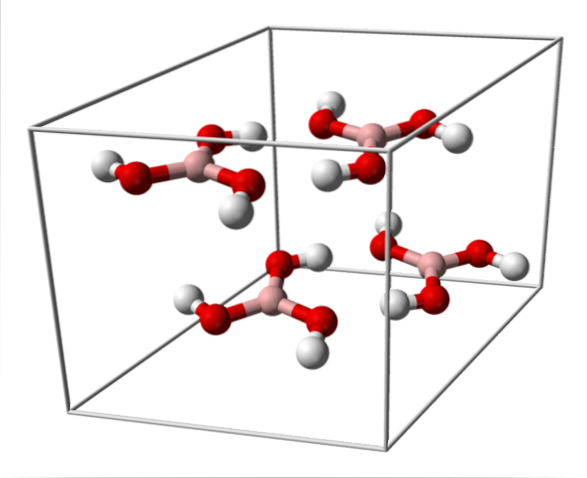
L'immagine in alto mostra la cella unitaria corrispondente alla struttura cristallina triclina per l'acido borico che, in determinate condizioni di sintesi, può assumere la struttura esagonale compatta. Si noti che ci sono quattro molecole per cellula unitaria e che sono disposte in due strati, A e B, alternati (non sono sovrapposti uno sopra l'altro).
A causa della simmetria e dell'orientamento dei legami B-OH, si può presumere che B (OH)3 è apolare; tuttavia, l'esistenza di legami idrogeno intermolecolari cambia la storia. Ogni molecola di B (OH)3 di dare o ricevere tre di questi ponti, con un totale di sei interazioni dipolo-dipolo, come osservato nell'immagine sottostante:
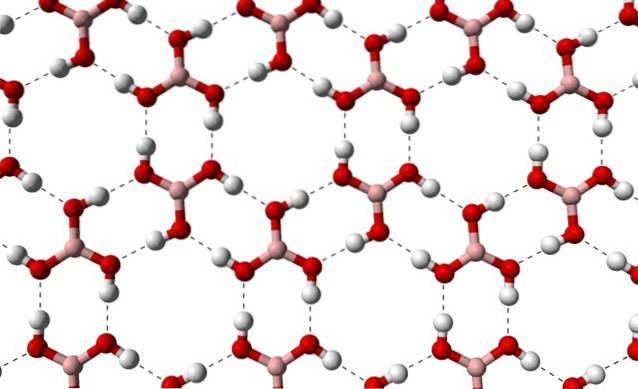
Si noti che questi legami idrogeno sono le interazioni direzionali che governano i cristalli di acido borico e stabiliscono modelli di aspetti ornamentali; anelli interni forse con spazio sufficiente per occludere alcune impurità che non sono nei difetti del cristallo.
Questi legami idrogeno, nonostante la bassa massa molecolare di B (OH)3, mantengono il loro vetro abbastanza coeso da aver bisogno di una temperatura di 171 ° C per sciogliersi. Non è noto quali effetti avrebbero le alte pressioni (nell'ordine di GPa) sugli strati molecolari di B (OH)3.
Proprietà
Nomi
IUPAC: acido borico e triidroossido borico. Altri nomi: acido ortoborico, acido boracico, sassolite, borofax e triidrossiborano.
Massa molare
61,83 g / mol
Aspetto fisico
Solido bianco limpido, incolore, cristallino. È disponibile anche in granuli o in polvere bianca. Leggermente cremoso al tatto.
Odore
Gabinetto
Gusto
Leggermente amaro
Punto di fusione
170,9 ºC
Punto di ebollizione
300 ºC
Solubilità dell'acqua
Moderatamente solubile in acqua fredda e solubile in acqua calda:
2,52 g / 100 mL (0 ºC)
27,50 g / 100 mL (100 ºC)
L'acido borico è parzialmente solubile in acqua e tende ad affondare in essa. Questa solubilità tende ad aumentare in presenza di acidi, come cloridrico, citrico e tartarico..
Solubilità in altri solventi
-Glicerolo: 17,5% a 25 ºC
-Glicole etilenico: 18,5% a 25 ºC
-Acetone: 0,6% a 25 ºC
-Acetato di etile: 1,5% a 25 ºC
-Metanolo: 172 g / L a 25 ºC
-Etanolo: 94,4 g / L a 25 ºC
Coefficiente di ripartizione ottanolo / acqua
Log P = -0,29
Acidità (pKa)
9.24. 12.4. 13.3. Queste sono le tre costanti delle loro rispettive dissociazioni per rilasciare H.+ in acqua.
pH
3,8 - 4,8 (3,3% in soluzione acquosa)
5,1 (0,1 molare)
Pressione del vapore
1.6 10-6 mmHg
Stabilità
Stabile in acqua
Decomposizione
Si decompone se riscaldato a temperature superiori a 100 ° C, formando anidride borica e acqua.
Reattività
L'acido borico forma sali solubili con cationi monovalenti, ad esempio: NaDueB4O7.10HDueO e sali insolubili con cationi bivalenti, CaB4O7.6HDueO.
In soluzione acquosa produce una soluzione acida, pensando che questa proprietà fosse dovuta alla sottrazione di gruppi OH- dell'acqua. L'acido borico è classificato come un acido debole del tipo Lewis.
L'acido borico reagisce con glicerolo e mannitolo, aumentando l'acidità del mezzo acquoso. Il pKa viene modificato da 9.2 a 5, a causa della formazione del chelato di boro-mannitolo [BC6H8ODue(OH)Due]-, che rilascia H.+.
Preparazione
L'acido borico si trova allo stato libero in emanazioni vulcaniche in regioni come la Toscana in Italia, le Isole Lipari e nello stato del Nevada, USA. Si trova anche in minerali come borace, boracite, ulexite e colemanite..
L'acido borico viene preparato principalmente dalla reazione del borace minerale (sodio tetraborato decaidrato) con acidi minerali, come acido cloridrico, acido solforico, ecc..
N / ADueB4O910HDueO + HCl => 4 H3BO3 + 2 NaCl + 5 HDueO
Viene anche preparato mediante idrolisi di boro trialogenuro e diborano..
L'acido borico è preparato dalla colemanite (CaDueB6Oundici6 oreDueO). La procedura consiste nel trattare il minerale con acido solforico per sciogliere i composti del boro.
Quindi, la soluzione in cui è presente acido borico viene separata dai frammenti non disciolti. La soluzione viene trattata con idrogeno solforato per far precipitare l'arsenico e le impurità di ferro. Il surnatante viene raffreddato per produrre un precipitato di acido borico e separarlo dalla sospensione..
Applicazioni
Nell'industria
L'acido borico è utilizzato nella produzione di fibra di vetro. Aiutando a ridurre il punto di fusione, aumenta la resistenza e l'efficienza della fibra di vetro tessile: un materiale utilizzato per rinforzare la plastica utilizzata nelle navi, nei tubi industriali e nei circuiti dei computer..
L'acido borico partecipa alla produzione del vetro borosilicato, che permette di ottenere un vetro resistente agli sbalzi di temperatura, utilizzabile nelle cucine delle case, nella vetreria nei laboratori, tubi fluorescenti, fibre ottiche, schermi LCD, ecc..
È utilizzato nell'industria metallurgica per indurire e trattare le leghe di acciaio, nonché per promuovere il rivestimento metallico dei materiali.
È utilizzato come componente chimico nella fratturazione idraulica (fracking): un metodo utilizzato nell'estrazione di petrolio e gas. L'acido borico agisce come ritardante di fiamma in cellulosa, plastica e materiali tessili impregnati di acido borico per aumentare la loro resistenza al fuoco..
In medicina
L'acido borico viene utilizzato diluito nel lavaggio oculare. Le capsule di gelatina di acido borico sono usate per trattare le infezioni fungine, in particolare la Candida albicans. È stato utilizzato anche nel trattamento dell'acne.
L'acido borico viene spruzzato sui calzini per prevenire le infezioni ai piedi, come il piede d'atleta. Allo stesso modo, le soluzioni contenenti acido borico vengono utilizzate nel trattamento dell'otite esterna nell'uomo e negli animali..
L'acido borico viene aggiunto ai flaconi utilizzati per la raccolta delle urine, che previene la contaminazione batterica prima di essere esaminati nei laboratori diagnostici..
Insetticida
L'acido borico viene utilizzato per controllare la proliferazione di insetti, come scarafaggi, termiti, formiche, ecc. Non uccide istantaneamente gli scarafaggi, poiché colpisce prima il loro sistema digestivo e nervoso, oltre a distruggere il loro esoscheletro.
L'acido borico esplica la sua azione lentamente, permettendo agli insetti che lo hanno ingerito di entrare in contatto con altri insetti, diffondendo così l'avvelenamento..
Preservazione
L'acido borico viene utilizzato per prevenire l'attacco del legno da parte di funghi e insetti, essendo utilizzato a tale scopo in combinazione con glicole etilenico. Questo trattamento è efficace anche nel controllo del limo e delle alghe..
Buffer PH
L'acido borico e la sua base coniugata formano un sistema tampone di pKa = 9,24, che indica che questo tampone è più efficace a pH alcalino, che non è usuale negli esseri viventi. Tuttavia, il tampone borato viene utilizzato nella regolazione del pH nelle piscine..
Reattori nucleari
L'acido borico ha la capacità di catturare i neutroni termici, il che riduce la possibilità di fissione nucleare incontrollata che può portare a incidenti nucleari..
agricoltura
Il boro è un elemento essenziale per la crescita delle piante, che ha portato all'uso di acido borico per il contributo dell'elemento. Tuttavia, troppo acido borico può danneggiare le piante, in particolare gli agrumi..
Controindicazioni
Evitare l'uso di acido borico su pelle denudata, ferite o prodotti ustionati che ne consentono l'assorbimento. Questo è un composto tossico all'interno del corpo e in alcuni casi può causare svenimenti, convulsioni, spasmi, tic facciali e bassa pressione sanguigna..
Il medico dovrebbe essere consultato per l'uso delle capsule vaginali di acido borico nelle donne in gravidanza, poiché è stato indicato che potrebbe causare deformazioni fetali e una diminuzione del peso corporeo del bambino alla nascita..
Va inoltre evitata la collocazione di acido borico, utilizzato come insetticida, in luoghi alla portata dei bambini, in quanto i bambini hanno una maggiore suscettibilità all'azione tossica dell'acido borico, stabilendo in essi la dose fatale da 2.000 a 3.000 mg.
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Acido borico. Estratto da: en.wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Acido borico. Database PubChem. CID = 7628. Estratto da: pubchem.ncbi.nlm.nih.gov
- The Editors of Encyclopaedia Britannica. (28 marzo 2019). Acido borico. Encyclopædia Britannica. Estratto da: britannica.com
- Carrier vibrante. (9 novembre 2018). Gli usi nascosti dell'acido borico nella tua vita quotidiana. Estratto da: carriervibrating.com
- Centro nazionale di informazione sui pesticidi. (s.f.). Acido borico. Recupero da: npic.orst.edu
- Redazione. (30 novembre 2017). Acido borico: proprietà e usi di questo composto chimico. Estratto da: acidos.info
- Cloruro di sodio. (2019). Acido borico. Estratto da: chlorurosodio.com
- Società Spagnola di Farmacia Ospedaliera. (s.f.). Acido borico. [PDF]. Recupero da: workgroups.sefh.es



Nessun utente ha ancora commentato questo articolo.