
Struttura, proprietà e usi del ciclopentano (C5H10)
Il ciclopentano è un idrocarburo ciclico, in particolare un cicloalcano. A sua volta, è un composto organico la cui formula molecolare è C5H10. Può essere visualizzato come la versione chiusa di n-pentano, catena aperta, in cui le sue estremità sono state unite dalla perdita di due atomi di idrogeno.
L'immagine in basso mostra lo scheletro del ciclopentano. Nota come appare geometrico il suo scheletro, che forma un anello pentagonale. Tuttavia, la sua struttura molecolare non è piatta, ma piuttosto presenta pieghe che cercano di stabilizzare e ridurre lo stress all'interno dell'anello. Il ciclopentano è un liquido altamente volatile e infiammabile, ma non infiammabile come n-pentano.
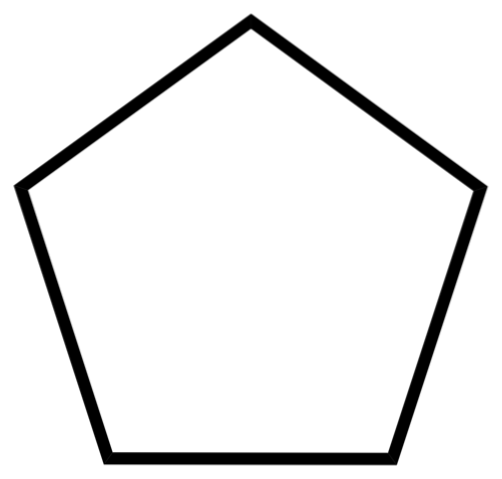
Grazie alla sua capacità di solvente, il ciclopentano è uno dei solventi più utilizzati nelle industrie chimiche. Non sorprende che molti prodotti con odori forti lo contengano nella loro composizione, essendo quindi infiammabile. Viene anche utilizzato come agente espandente per schiume poliuretaniche utilizzate nei frigoriferi..
Indice articolo
- 1 Struttura del ciclipentano
- 1.1 Interazioni intermolecolari
- 1.2 Conformazioni e sollecitazione dell'anello
- 2 Proprietà del ciclipentano
- 2.1 Aspetto fisico
- 2.2 Massa molare
- 2.3 Punto di fusione
- 2.4 Punto di ebollizione
- 2.5 Punto di infiammabilità
- 2.6 Temperatura di autoaccensione
- 2.7 Calore di vaporizzazione
- 2.8 Viscosità
- 2.9 Indice di rifrazione
- 2.10 Pressione di vapore
- 2.11 Densità
- 2.12 Solubilità
- 2.13 Coefficiente di ripartizione ottanolo / acqua
- 2.14 Reattività
- 3 usi
- 3.1 Solvente industriale
- 3.2 Fonte di etilene
- 3.3 Schiume poliuretaniche isolanti
- 4 Riferimenti
Struttura del ciclipentano
Interazioni intermolecolari
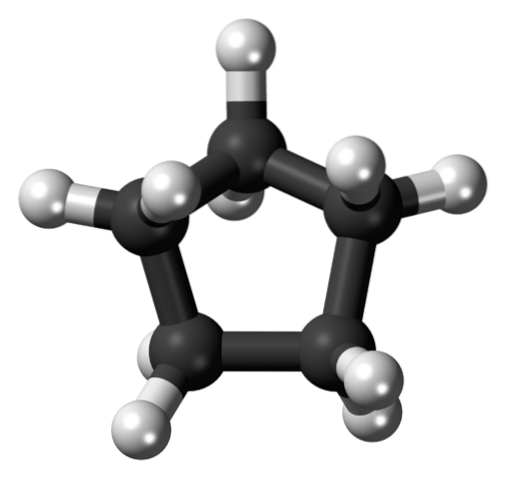
Nella prima immagine è stato mostrato lo scheletro del ciclopentano. Sopra vediamo ora che è più di un semplice pentagono: atomi di idrogeno (sfere bianche) sporgono ai suoi bordi, mentre atomi di carbonio compongono l'anello pentagonale (sfere nere).
Avendo solo legami C-C e C-H, il loro momento di dipolo è trascurabile, quindi le molecole di ciclopentano non possono interagire tra loro attraverso forze dipolo-dipolo. Invece, sono tenuti insieme grazie alle forze dispersive di Londra, con gli anelli che tentano di impilarsi l'uno sull'altro..
Questo impilamento offre un'area di contatto maggiore di quella disponibile tra le molecole lineari di n-pentano. Di conseguenza, il ciclopentano ha un punto di ebollizione più alto di n-pentano, nonché una pressione di vapore inferiore.
Le forze di dispersione sono responsabili del ciclopentano che forma un cristallo molecolare quando congelato a -94 ºC. Sebbene non ci siano molte informazioni sulla sua struttura cristallina, è polimorfa e ha tre fasi: I, II e III, con la fase II che è una miscela disordinata di I e III.
Conformazioni e stress anulare
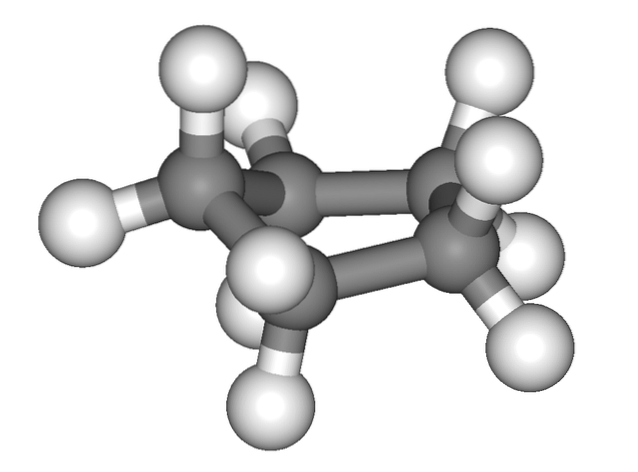
L'immagine sopra dà la falsa impressione che il ciclopentano sia piatto; ma non è così. Tutti i suoi atomi di carbonio hanno ibridazione sp3, quindi i loro orbitali non sono sullo stesso piano. Inoltre, come se non bastasse, gli atomi di idrogeno sono molto vicini tra loro, fortemente respinti quando vengono eclissati..
Si parla quindi di conformazioni, una delle quali è la mezza sedia (immagine in alto). Da questo punto di vista, si apprezza chiaramente che l'anello del ciclopentano ha delle pieghe, che aiutano a ridurre la sua tensione dell'anello a causa dei suoi atomi di carbonio così vicini tra loro..
Questa tensione è dovuta al fatto che i legami C-C presentano angoli inferiori a 109,5º, il valore ideale per l'ambiente tetraedrico come risultato delle loro ibridazioni sp.3.
Tuttavia, nonostante questo stress, il ciclopentano è un composto più stabile e meno infiammabile del pentano. Ciò può essere verificato confrontando i loro diamanti di sicurezza, in cui l'infiammabilità del ciclopentano è 3, mentre quella del pentano, 4.
Proprietà del ciclipentano
Aspetto fisico
Liquido incolore con un leggero odore simile al petrolio.
Massa molare
70,1 g / mol
Punto di fusione
-93,9 ºC
Punto di ebollizione
49,2 ºC
punto d'infiammabilità
-37,2 ºC
Temperatura di autoaccensione
361 ºC
Calore di vaporizzazione
28,52 kJ / mol a 25 ºC
Viscosità
0,413 mPa s
Indice di rifrazione
1.4065
Pressione del vapore
45 kPa a 20 ° C. Questa pressione corrisponde a circa 440 atm, comunque inferiore a quella del n-Pentano: 57,90 kPa.
Qui si manifesta l'effetto della struttura: l'anello ciclopentano consente interazioni intermolecolari più efficaci, che lega e trattiene maggiormente le sue molecole all'interno del liquido rispetto alle molecole lineari del n-pentano. Pertanto, quest'ultimo ha una pressione di vapore più elevata.
Densità
0,751 g / cm3 a 20 ° C. D'altra parte, i suoi vapori sono 2,42 volte più densi dell'aria.
Solubilità
In un litro d'acqua a 25ºC, solo 156 mg di ciclopentano si dissolvono, a causa della sua natura idrofobica. Tuttavia, è miscibile in solventi non polari come altre paraffine, eteri, benzene, tetracloruro di carbonio, acetone ed etanolo..
Coefficiente di ripartizione ottanolo / acqua
3
Reattività
Il ciclopentano è stabile se conservato correttamente. Non è una sostanza reattiva perché i suoi legami C-H e C-C non sono facili da rompere, anche se porterebbe al rilascio di energia causato dalla tensione dell'anello.
In presenza di ossigeno, brucerà in una reazione di combustione, sia completa che incompleta. Poiché il ciclopentano è un composto molto volatile, deve essere conservato in luoghi dove non può essere esposto a nessuna fonte di calore..
Nel frattempo, in assenza di ossigeno, il ciclopentano subirà una reazione di pirolisi, decomponendosi in molecole più piccole e insature. Uno di questi è l'1-pentene, che mostra che il calore rompe l'anello ciclopentano per produrre un alchene.
D'altra parte, il ciclopentano può reagire con il bromo sotto la radiazione ultravioletta. In questo modo, uno dei suoi legami C-H viene sostituito da C-Br, che a sua volta può essere sostituito da altri gruppi; e quindi stanno emergendo derivati del ciclopentano.
Applicazioni
Solvente industriale
Il carattere idrofobo e apolare del ciclopentano lo rende un solvente sgrassante, insieme ad altri solventi paraffinici. Per questo motivo, di solito fa parte delle formulazioni di molti prodotti, come colle, resine sintetiche, vernici, adesivi, tabacco e benzina..
Fonte di etilene
Quando il ciclopentano viene sottoposto a pirolisi, una delle sostanze più importanti che genera è l'etilene, che ha innumerevoli applicazioni nel mondo dei polimeri..
Schiume poliuretaniche isolanti
Uno degli usi più notevoli del ciclopentano è come agente espandente per la produzione di schiume poliuretaniche isolanti; ovvero i vapori di ciclopentano, a causa della loro alta pressione, espandono il materiale polimerico fino a formare una schiuma con proprietà benefiche da utilizzare nel telaio di frigoriferi o congelatori.
Alcune aziende hanno scelto di sostituire gli HFC al ciclopentano nella produzione di materiali isolanti, poiché non contribuisce al deterioramento dello strato di ozono e riduce anche il rilascio di gas serra nell'ambiente.
Riferimenti
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. (10th edizione.). Wiley plus.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Wikipedia. (2020). Ciclopentano. Estratto da: en.wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2020). Ciclopentano. Database PubChem, CID = 9253. Estratto da: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Ciclopentano. ScienceDirect. Estratto da: sciencedirect.com
- GE Appliances. (2011, 11 gennaio). Riduzione delle emissioni di gas serra negli impianti di produzione di frigoriferi di GE. Estratto da: pressroom.geappliances.com



Nessun utente ha ancora commentato questo articolo.