
Formula di carica formale, come calcolarla ed esempi
Il carica formale (CF) è quello che viene assegnato a un atomo di una molecola o ione, che consente di spiegare le sue strutture e proprietà chimiche basate su di esso. Questo concetto implica la considerazione del massimo carattere di covalenza nel legame A-B; cioè, la coppia di elettroni è condivisa equamente tra A e B.
Per capire quanto sopra, l'immagine in basso mostra due atomi legati: uno designato con la lettera A e l'altro con la lettera B. Come si può vedere, nell'intercetta dei cerchi si forma un legame con la coppia ":". In questa molecola eteronucleare, se A e B hanno elettronegatività uguali, la coppia ":" rimane equidistante sia da A che da B.
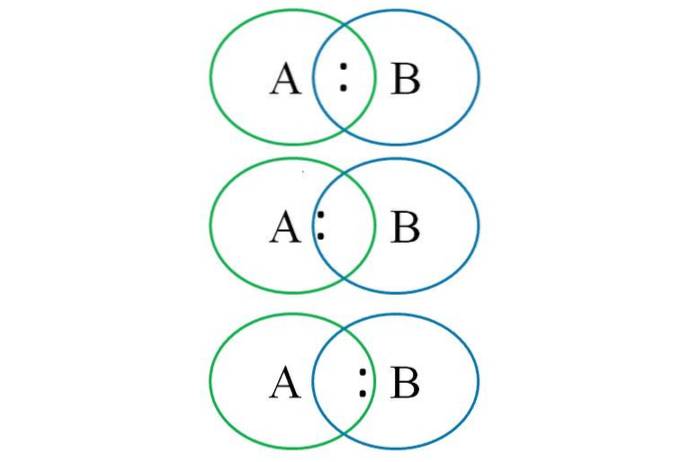
Tuttavia, poiché due atomi diversi non possono avere proprietà identiche, la coppia ":" è attratta da quella più elettronegativa. In questo caso, se A è più elettronegativo di B, la coppia ":" è più vicina ad A che a B. L'opposto si verifica quando B è più elettronegativo di A, avvicinandosi ora a ":" a B.
Quindi, per assegnare le cariche formali sia ad A che a B, è necessario considerare il primo caso (quello sopra l'immagine). Se il legame puramente covalente A-B fosse rotto, si verificherebbe una rottura omolitica, generando i radicali liberi A · e · B.
Indice articolo
- 1 Benefici qualitativi dell'impiego del carico formale
- 2 Formula e come calcolarla
- 2.1 Variazioni del calcolo in base alla struttura
- 3 Esempi di calcoli di carichi formali
- 3.1 BF4- (ione tetrafluoroborato)
- 3.2 BeH2 (berillio idruro)
- 3.3 CO (monossido di carbonio)
- 3.4 NH4 + (ione ammonio), NH3 e NH2- (ione ammide)
- 4 Riferimenti
Benefici qualitativi dell'impiego del carico formale
Gli elettroni non sono fissi, come nell'esempio precedente, ma viaggiano e si perdono attraverso gli atomi della molecola o dello ione. Se è una molecola biatomica, è noto che la coppia ":" deve essere condivisa o errante tra i due atomi; lo stesso accade in una molecola del tipo A-B-C, ma con maggiore complessità.
Tuttavia, quando si studia un atomo e si assume una covalenza del cento per cento nei suoi legami, è più facile stabilire se guadagna o perde elettroni all'interno del composto. Per determinare questo guadagno o perdita, il tuo stato di base o libero deve essere confrontato con il tuo ambiente elettronico..
In questo modo è possibile assegnare una carica positiva (+) se l'atomo perde un elettrone, oppure una carica negativa (-) quando invece guadagna un elettrone (i segni vanno scritti all'interno di un cerchio).
Pertanto, sebbene gli elettroni non possano essere localizzati esattamente, queste cariche formali (+) e (-) sulle strutture si conformano nella maggior parte dei casi alle proprietà chimiche previste..
Cioè, la carica formale di un atomo è strettamente correlata alla geometria molecolare del suo ambiente e alla sua reattività all'interno del composto..
Formula e come calcolarla
Gli addebiti formali sono assegnati arbitrariamente? La risposta è no. Per questo, il guadagno o la perdita di elettroni deve essere calcolato assumendo legami puramente covalenti, e ciò si ottiene attraverso la seguente formula:
CF = (numero di gruppo dell'atomo) - (numero di legami che forma) - (numero di elettroni non condivisi)
Se l'atomo ha un CF con valore +1, gli viene assegnata una carica positiva (+); mentre se hai un CF con un valore di -1, allora gli viene assegnata una carica negativa (-).
Per calcolare correttamente il CF, è necessario seguire i seguenti passaggi:
- Individua in quale gruppo si trova l'atomo nella tavola periodica.
- Conta il numero di legami che forma con i suoi vicini: i doppi legami (=) valgono due e i tripli legami valgono tre (≡).
- Infine, conta il numero di elettroni non condivisi, che possono essere facilmente osservati con le strutture di Lewis.
Variazioni di calcolo in base alla struttura
Data la molecola lineare A-B-C-D, le cariche formali per ogni atomo possono variare se la struttura, ad esempio, è ora scritta come: B-C-A-D, C-A-B-D, A-C-D-B, ecc. Questo perché ci sono atomi che, condividendo più elettroni (formando più legami), acquisiscono CF positiva o negativa.
Quindi quale delle tre possibili strutture molecolari corrisponde al composto ABCD? La risposta è: quella che generalmente ha i valori CF più bassi; allo stesso modo, quello che assegna cariche negative (-) agli atomi più elettronegativi.
Se C e D sono più elettronegativi di A e B, condividendo più elettroni acquisiscono di conseguenza cariche formali positive (visto da una regola mnemonica).
Pertanto, la struttura più stabile, e la più energeticamente favorita, è C-A-B-D, poiché in questo sia C che B formano un solo legame. D'altra parte, la struttura A-B-C-D e quelle che hanno C o B che formano due legami (-C- o -D-), sono più instabili.
Quale di tutte le strutture è la più instabile? A-C-D-B, perché non solo C e D formano due legami, ma anche le loro cariche formali negative (-) sono adiacenti l'una all'altra, destabilizzando ulteriormente la struttura.
Esempi di calcoli formali del carico
BF4- (ione tetrafluoroborato)
L'atomo di boro è circondato da quattro atomi di fluoro. Poiché B appartiene al gruppo IIIA (13), manca di elettroni non condivisi e forma quattro legami covalenti, il suo CF è (3-4-0 = -1). D'altra parte, per F, un elemento del gruppo VIIA (17), il suo CF è (7-6-1 = 0).
Per determinare la carica dello ione o della molecola è sufficiente sommare il CF individuale degli atomi che lo compongono: (1 (-1) + 4 (0) = -1).
Tuttavia, la CF per B non ha alcun significato reale; cioè, la più alta densità di elettroni non risiede su di essa. In realtà, questa densità elettronica è distribuita verso i quattro atomi di F, un elemento molto più elettronegativo di B.
BeHDue (berillio idruro)
L'atomo di berillio appartiene al gruppo IIA (2), forma due legami e manca, ancora una volta, di elettroni non condivisi. Pertanto, i CF per Be e H sono:
CFEssere= 2-2-0 = 0
CFH= 1-1-0 = 0
Caricare BeHDue= 1 (0) + 2 (0) = 0
CO (monossido di carbonio)
La sua struttura di Lewis può essere rappresentata come: C≡O: (sebbene abbia altre strutture di risonanza). Ripetendo il calcolo CF, questa volta per C (del gruppo IVA) e O (del gruppo VIA), abbiamo:
CFC= 4-3-2 = -1
CFO= 6-3-2 = +1
Questo è un esempio in cui le accuse formali non sono conformi alla natura degli elementi. O è più elettronegativo di C e quindi non dovrebbe portare un positivo.
Le altre strutture (C = O e (+)CO(-)), sebbene rispettino l'assegnazione coerente delle cariche, non rispettano la regola dell'ottetto (C ha meno di otto elettroni di valenza).
NH4+ (ione ammonio), NH3 e NHDue- (ione ammide)
più elettroni N condivide, più positivo è il suo CF (anche lo ione ammonio, poiché non ha disponibilità di energia per formare cinque legami).
Applicando ugualmente i calcoli per N nello ione ammonio, ammoniaca e ione ammide, abbiamo quindi:
CF = 5-4-0 = +1 (NH4+)
CF = 5-3-2 = 0 (NH3)
E infine:
CF = 5-2-4 = -1 (NHDue-)
Cioè, nell'NHDue- N ha quattro elettroni non condivisi e li condivide tutti quando forma NH4+. Il CF per H è uguale a 0 e quindi il calcolo viene salvato.
Riferimenti
- James. (2018). Un'abilità chiave: come calcolare l'addebito formale. Estratto il 23 maggio 2018 da: masterorganicchemistry.com
- Dottor Ian Hunt. Dipartimento di Chimica, Università di Calgary. Spese formali. Estratto il 23 maggio 2018 da: chem.ucalgary.ca
- Spese formali. [PDF]. Estratto il 23 maggio 2018 da: chem.ucla.edu
- Jeff D. Cronk. Carica formale. Estratto il 23 maggio 2018 da: guweb2.gonzaga.edu
- Whitten, Davis, Peck e Stanley. Chimica. (8 ° ed.). CENGAGE Learning, pagg. 268-270.
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione., P. 38). Mc Graw Hill.
- Monica Gonzalez. (10 agosto 2010). Carica formale. Estratto il 23 maggio 2018 da: quimica.laguia2000.com



Nessun utente ha ancora commentato questo articolo.