
Struttura, proprietà, formazione, usi del carbonato di calcio
Il carbonato di calcio è un composto inorganico la cui formula chimica è CaCO3. Si trova principalmente in minerali come calcite e aragonite. Costituisce anche calcare, una roccia sedimentaria in cui è presente la calcite minerale..
Questo importante carbonato metallico è ottenuto industrialmente mediante estrazione e macinazione dei minerali che lo contengono; il marmo viene utilizzato principalmente per questo scopo. Un altro processo consiste nell'uso dell'ossido di calcio, che viene convertito in idrossido di calcio, facendo precipitare il carbonato di calcio da esso aggiungendo anidride carbonica. In questo modo si ottengono cristalli di un'ampia gamma di dimensioni..

Possono essere utilizzati anche per la produzione industriale di CaCO3, in piccola scala, gusci di vongole, gusci d'uovo e gusci di ostriche in cui è presente.
Il carbonato di calcio presente nel calcare viene sciolto dall'anidride carbonica nell'acqua, generando bicarbonato di calcio. Questa azione può provocare caverne ed è causa di alcalinizzazione dell'acqua; evento di grande importanza per il mantenimento della vita in esso.
È stato utilizzato nella costruzione e nell'elaborazione di sculture; esempi di questo sono il Partenone ad Atene, la Cattedrale di Cracovia e la scultura di Abraham Lincoln a Washington. Tuttavia, la sua suscettibilità alle piogge acide ne ha diminuito l'uso nell'edilizia..
Il carbonato di calcio ha avuto molteplici applicazioni nell'industria come materiale di riempimento in plastica e carta. In medicina è stato utilizzato per controllare l'acidità gastrica; come integratore alimentare di calcio; per controllare la fosfatemia nei pazienti con insufficienza renale cronica, ecc..
Indice articolo
- 1 Struttura
- 1.1 Durezza delle proteine
- 2 Proprietà
- 2.1 Altri nomi
- 2.2 Massa molare
- 2.3 Descrizione fisica
- 2.4 Aroma
- 2.5 Punti di fusione e di ebollizione
- 2.6 Solubilità
- 2.7 Densità
- 2.8 Decomposizione
- 2.9 pH
- 2.10 Indice di rifrazione
- 2.11 Incompatibilità
- 2.12 Entalpia di fusione
- 2.13 Costante del prodotto di solubilità
- 2.14 Durezza
- 2.15 Transizioni di fase
- 2.16 Reattività
- 3 Formazione
- 4 Forme di carbonato di calcio
- 5 Usi
- 5.1 Industriale
- 5.2 Medici
- 5.3 Altri
- 6 Riferimenti
Struttura
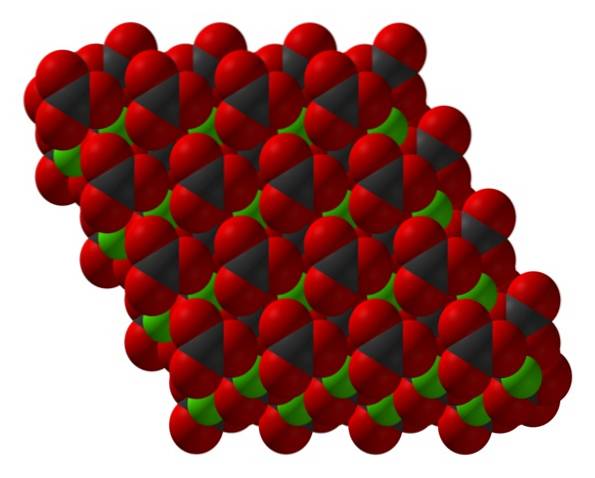
La formula del carbonato di calcio, CaCO3, indica che il rapporto tra ioni CaDue+ e CO3Due- è 1: 1; cioè, per ogni CaDue+ c'è un CO3Due- controparte che interagisce elettrostaticamente con esso. Pertanto, il legame ionico finisce per disporre questi ioni per formare modelli strutturali che definiscono un cristallo..
L'immagine in alto mostra la struttura di CaCO3. Le sfere verdi corrispondono ai cationi CaDue+, e le sfere rosse e nere agli anioni CO3Due-. Si noti che la struttura sembra essere composta da più strati: uno di calcio e l'altro di carbonato; il che significa che si cristallizza in una struttura esagonale compatta.
Questa fase esagonale (β-CaCO3) corrisponde a un polimorfo. Ce ne sono altri due: l'ortorombico (λ-CaCO3) e un esagonale ancora più denso (μ-CaCO3). L'immagine sotto aiuta a visualizzare meglio l'esagono felice:
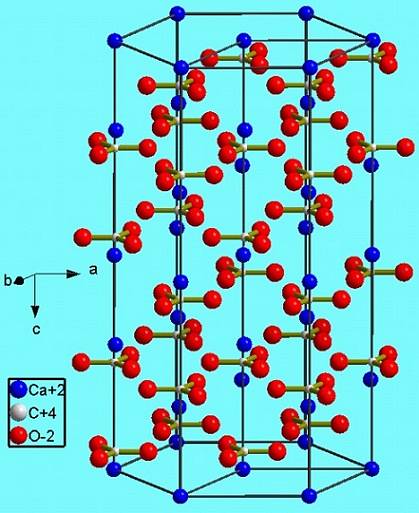
Tuttavia, a seconda della temperatura (e per questo sale in misura minore la pressione) gli ioni nelle loro vibrazioni si riadattano ad altre strutture; questi sono i polimorfi già citati (β, λ e μ).
Per come suonano, non sono molto conosciuti, a meno che non vengano menzionati con i loro nomi mineralogici in una sezione futura.
Durezza delle proteine
Cristalli CaCO3 Non sono soli: possono ospitare impurità come altri cationi metallici che li colorano; o proteine, incorporando una matrice organica che in qualche modo contribuisce alla sua durezza naturale.
Le proteine riducono la tensione che i cristalli subiscono l'uno contro l'altro sotto pressione o impatto. Come? Quando inserito tra i cristalli, agendo come se fosse un "cuscinetto" (simile al set mattone-cemento-mattone).
Questo è il motivo per cui questo composto o minerale è biocompatibile e non sorprende che faccia parte delle unghie, delle conchiglie, delle conchiglie o delle ossa dei ricci. È stata una fonte di ispirazione per coloro che si dedicano allo sviluppo di nuovi materiali.
Proprietà
Altri nomi
-Aragonite
-Calcite
-Volterito
-Latte di calcio
-Lavagna
-Marmo
Massa molare
100,086 g / mol.
Descrizione fisica
Polvere bianca inodore.
Gusto
Gessoso, insapore.
Punti di fusione e di ebollizione
Si decompone a causa del rilascio di CODue prima ancora che si sciolga o bolle.
Solubilità
Praticamente insolubile in acqua e alcool. Si dissolve effervescente negli acidi acetico e cloridrico diluiti. Gli idrossidi tuttavia riducono la sua solubilità. Nel frattempo, i sali di ammonio e l'anidride carbonica aumentano la solubilità del carbonato di calcio in acqua..
Densità
2,7-2,95 g / cm3.
Decomposizione
A circa 825 ºC si decompone in ossido di calcio (calce) e anidride carbonica (CODue).
pH
8-9
Indice di rifrazione
-1.7216 a 300 nm e 1.6584 a 589 nm (calcite).
-1,5145 a 300 nm e 1,4864 a 589 nm (aragonite).
Incompatibilità
Con acidi, allume e sali di ammonio.
Entalpia di fusione
36 kJ / mol a 800 ºC (calcite).
Costante del prodotto di solubilità
3.36 10-9 a 25 ºC.
Durezza
-3.0 (calcite)
-3.5 - 4.0 (aragonite) sulla scala di Mohs.
Transizioni di fase
L'aragonite è metastabile e si trasforma irreversibilmente in calcite se riscaldata in aria secca a 400ºC..
Reattività
Il carbonato di calcio reagisce con gli acidi, rilasciando anidride carbonica, calcio ionico e acqua..
Il carbonato di calcio si combina con l'acqua satura di anidride carbonica, equivalente all'acido carbonico (H.DueCO3), per formare bicarbonato di calcio.
Formazione
Gesso, marmo e calcare, i primi due minerali e un materiale roccioso il terzo, contengono carbonato di calcio e sono di origine sedimentaria, si pensa siano stati formati dalla sedimentazione delle lumache nel corso di milioni di anni..
Il PH potrebbe essere il fattore più importante nella formazione di polimorfi a una temperatura di 24ºC. La vaterite è il prodotto principale in un intervallo di pH compreso tra 8,5 e 10; l'aragonite ha pH 11; e calcite a pH> 12.
Inoltre, molte alghe d'acqua dolce sono note per costruire cristalli di calcite se coltivate in un ambiente saturo di calcio. Inoltre, le microalghe sono in grado di provocare la precipitazione del carbonato di calcio.
Forme di carbonato di calcio
Le immagini seguenti mostrano le tre forme principali o polimorfi per il carbonato di calcio:



Dall'alto verso il basso sono i polimorfi calcite, aragonite e vaterite. Notare a prima vista la differenza tra la morfologia dei suoi cristalli (il colore è tipico delle sue origini e le caratteristiche dei suoi dintorni).
La vaterite è più opaca della calcite, quest'ultima addirittura diventando completamente trasparente (longherone islandese) ed è stata quindi utilizzata in gioielleria e applicazioni ottiche. Nel frattempo, i cristalli di aragonite assomigliano a piccoli monoliti allungati.
Se si osservassero al microscopio elettronico campioni di questi tre polimorfi, i loro cristalli (con toni grigiastri per il fatto che la tecnica non consente la risoluzione del colore), si troverebbero le stesse morfologie delle scale macroscopiche; cioè a colpo d'occhio.
Tra questi tre polimorfi, la calcite è la più abbondante e stabile, seguita dall'aragonite, e infine dalla vaterite, la più rara delle forme di CaCO3
Applicazioni
Industriale
Il carbonato di calcio aumenta la resistenza alla torsione e alla trazione della gomma sintetica e naturale, mantenendone la flessibilità. È utilizzato nell'industria delle costruzioni come ingrediente nel cemento e come materia prima per la calce. Il suo utilizzo è stato ridotto perché danneggiato dalle piogge acide.
Il carbonato di calcio è utilizzato nella purificazione del ferro. Sotto forma di calce rimuove l'anidride solforosa presente nel metallo. Viene utilizzato nella purificazione dello zucchero di barbabietola. Un tempo era usato come gesso da lavagna, ma è stato sostituito da gesso per questa applicazione.
Il carbonato di calcio viene miscelato con lo stucco che viene utilizzato nell'installazione del vetro. Il terreno viene utilizzato come materiale di riempimento nella pellicola microporosa utilizzata nei pannolini. Viene anche utilizzato come materiale di riempimento in materie plastiche come il PVC. Inoltre, aumenta la resistenza della plastica.
Il carbonato di calcio viene utilizzato per aumentare la capacità coprente delle vernici. Viene utilizzato come materiale di riempimento della carta perché è più economico della fibra di legno e può rappresentare più del 10% della carta.
Medici
È usato come antiacido per combattere l'iperacidità gastrica e alleviare l'indigestione. È usato come integratore alimentare di calcio e nel trattamento e nella prevenzione dell'osteoporosi. È usato nel trattamento dell'iperfosfatemia in pazienti con insufficienza renale cronica..
È stato utilizzato per ridurre gli effetti indesiderati degli inibitori della proteasi utilizzati nel trattamento dell'HIV, con una riduzione della diarrea osservata nei pazienti.
Produce una diminuzione della pressione sanguigna nelle donne in gravidanza con ipertensione e preeclampsia, poiché entrambe potrebbero essere associate a una maggiore richiesta di calcio dovuta alla presenza fetale.
Altri
Il carbonato di calcio viene utilizzato in agricoltura come fertilizzante e per combattere l'acidità del suolo. È usato come conservante, conservante del colore e alimento rassodante.
Inoltre, è un ingrediente del dentifricio e funge da abrasivo in polvere per la pulizia e il lavaggio..
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Carbonato di calcio. Estratto da: en.wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Carbonato di calcio. Database PubChem., CID = 10112. Estratto da: pubchem.ncbi.nlm.nih.gov
- Kai-Yin Chong, Chin-Hua Chia e Sarani Zakaria. (2014). Carbonato di calcio polimorfo su reazione termica. Atti della conferenza AIP 1614, 52; doi.org/10.1063/1.4895169
- Greg Watry. (1 novembre 2016). Alla scoperta di come i cristalli di carbonato di calcio acquistano forza. Vantaggio del marketing aziendale. Estratto da: rdmag.com
- Elementi americani. (2019). Carbonato di calcio. Estratto da: americanelements.com
- ElSevier. (2019). Carbonato di calcio. ScienceDirect. Estratto da: sciencedirect.com
- Libro chimico. (2017). Carbonato di calcio. Estratto da: chemicalbook.com


Nessun utente ha ancora commentato questo articolo.