
Proprietà delle anidridi, come si formano e applicazioni
Il anidridi Sono composti chimici che hanno origine dall'unione di due molecole attraverso il rilascio di acqua. Quindi, potrebbe essere visto come una disidratazione delle sostanze iniziali; anche se non è esattamente vero.
Nella chimica organica e inorganica se ne fa menzione, e in entrambi i rami la loro comprensione differisce in misura apprezzabile. Ad esempio, in chimica inorganica gli ossidi basici e acidi sono considerati rispettivamente come le anidridi dei loro idrossidi e acidi, poiché i primi reagiscono con l'acqua per formare i secondi..
In questo caso, può sorgere confusione tra i termini "anidro" e "anidride". Generalmente, anidro si riferisce a un composto a cui è stato disidratato senza cambiamenti nella sua natura chimica (non c'è reazione); mentre con un'anidride, c'è un cambiamento chimico, riflesso nella struttura molecolare.
Se gli idrossidi e gli acidi vengono confrontati con i loro corrispondenti ossidi (o anidridi), si vedrà che c'è stata una reazione. D'altra parte, alcuni ossidi o sali possono essere idratati, perdere acqua e rimanere gli stessi composti; ma, senza acqua, cioè anidro.
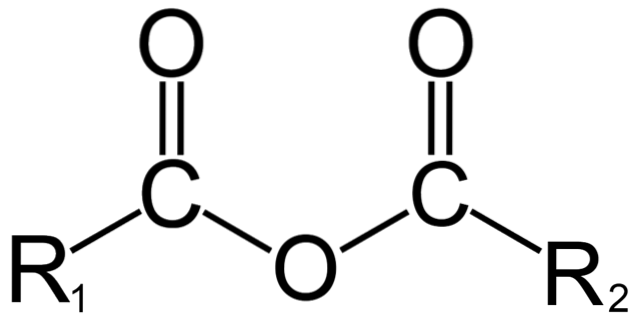
In chimica organica, invece, ciò che si intende per anidride è la definizione iniziale. Ad esempio, una delle anidridi più note sono quelle derivate da acidi carbossilici (immagine in alto). Questi consistono nell'unione di due gruppi acilici (-RCO) attraverso un atomo di ossigeno.
Nella sua struttura generale è indicata R1 per un gruppo acile e RDue per il secondo gruppo acile. Perché R1 e RDue sono diversi, provengono da diversi acidi carbossilici ed è quindi un'anidride acida asimmetrica. Quando entrambi i sostituenti R (aromatici o meno) sono uguali, in quel caso si parla di un'anidride acida simmetrica.
Quando due acidi carbossilici si legano per formare l'anidride, l'acqua può o meno formarsi, così come altri composti. Tutto dipenderà dalla struttura di questi acidi.
Indice articolo
- 1 Proprietà delle anidridi
- 1.1 Reazioni chimiche
- 2 Come si formano le anidridi?
- 2.1 Anidridi cicliche
- 3 Nomenclatura
- 4 Applicazioni
- 4.1 Anidridi organiche
- 5 esempi
- 5.1 Anidride succinica
- 5.2 Anidride glutarica
- 6 Riferimenti
Proprietà delle anidridi
Le proprietà delle anidridi dipenderanno da quelle a cui ti riferisci. Quasi tutti hanno in comune che reagiscono con l'acqua. Tuttavia, per le cosiddette anidridi di base inorganiche, in realtà molte di esse sono persino insolubili in acqua (MgO), quindi questa affermazione si concentrerà sulle anidridi degli acidi carbossilici.
I punti di fusione e di ebollizione ricadono sulla struttura molecolare e sulle interazioni intermolecolari per il (RCO)DueOppure, questa è la formula chimica generale di questi composti organici.
Se la massa molecolare di (RCO)DueOppure è basso, probabilmente un liquido incolore a temperatura e pressione ambiente. Ad esempio, l'anidride acetica (o anidride etanoica), (CH3CO)DueOppure è un liquido di maggiore importanza industriale, essendo la sua produzione molto vasta..
La reazione tra anidride acetica e acqua è rappresentata dalla seguente equazione chimica:
(CH3CO)DueO + HDueO => 2CH3COOH
Si noti che quando viene aggiunta la molecola d'acqua, vengono rilasciate due molecole di acido acetico. La reazione inversa, tuttavia, non può verificarsi per l'acido acetico:
2CH3COOH => (CH3CO)DueO + HDueO (non si verifica)
È necessario ricorrere a un altro percorso sintetico. Gli acidi dicarbossilici, d'altra parte, possono farlo riscaldando; ma verrà spiegato nella prossima sezione.
Reazioni chimiche
Idrolisi
Una delle reazioni più semplici delle anidridi è la loro idrolisi, che è stata appena dimostrata per l'anidride acetica. Oltre a questo esempio, c'è quello dell'anidride dell'acido solforico:
HDueSDueO7 + HDueO <=> 2HDueSW4
Qui hai un'anidride acida inorganica. Nota che per l'HDueSDueO7 (chiamato anche acido disolforico), la reazione è reversibile, quindi riscaldando H.DueSW4 concentrato dà luogo alla formazione della sua anidride. Se invece è una soluzione diluita di HDueSW4, Così viene rilasciato3, anidride solforica.
Esterificazione
Le anidridi acide reagiscono con gli alcoli, con la piridina in mezzo, per dare un estere e un acido carbossilico. Si consideri ad esempio la reazione tra anidride acetica ed etanolo:
(CH3CO)DueO + CH3CHDueOH => CH3CODueCHDueCH3 + CH3COOH
Formando così l'estere etanoato di etile, CH3CODueCHDueCH3, e acido etanoico (acido acetico).
In pratica, ciò che accade è la sostituzione dell'idrogeno del gruppo idrossile, con un gruppo acile:
R1-OH => R1-OCORDue
Nel caso di (CH3CO)DueOppure, il suo gruppo acile è -COCH3. Pertanto, si dice che il gruppo OH sia sottoposto ad acilazione. Tuttavia, acilazione ed esterificazione non sono concetti intercambiabili; l'acilazione può avvenire direttamente su un anello aromatico, noto come acilazione di Friedel-Crafts.
Pertanto, gli alcoli in presenza di anidridi acide vengono esterificati mediante acilazione.
D'altra parte, solo uno dei due gruppi acilici reagisce con l'alcol, l'altro rimane con l'idrogeno, formando un acido carbossilico; quello per il caso di (CH3CO)DueOppure è l'acido etanoico.
Amidation
Le anidridi acide reagiscono con l'ammoniaca o le ammine (primarie e secondarie) per dare origine alle ammidi. La reazione è molto simile all'esterificazione appena descritta, ma il ROH è sostituito da un'ammina; per esempio, un'ammina secondaria, RDueNH.
Di nuovo, la reazione tra (CH3CO)DueO e dietilammina, EtDueNH:
(CH3CO)DueO + 2EtDueNH => CH3CONEtDue + CH3COO- +NHDueEtDue
E dietilacetamide, CH3CONEtDue, e un sale carbossilato di ammonio, CH3COO- +NHDueEtDue.
Sebbene l'equazione possa sembrare un po 'difficile da capire, guarda come funziona il gruppo -COCH3 sostituire la H di un EtDueNH per formare l'ammide:
EtDueNH => EtDueNCOCH3
Piuttosto che l'ammidazione, la reazione è ancora acilazione. Tutto si riassume in quella parola; questa volta, l'ammina subisce l'acilazione e non l'alcol.
Come si formano le anidridi?
Le anidridi inorganiche si formano facendo reagire l'elemento con l'ossigeno. Pertanto, se l'elemento è metallico, si forma un ossido metallico o un'anidride basica; e se è non metallico, si forma un ossido non metallico o un'anidride acida.
Per le anidridi organiche, la reazione è diversa. Due acidi carbossilici non possono unirsi direttamente per rilasciare acqua e formare anidride acida; è necessaria la partecipazione di un composto che non è stato ancora menzionato: cloruro di acile, RCOCl.
L'acido carbossilico reagisce con il cloruro acilico, producendo la rispettiva anidride e acido cloridrico:
R1COCl + RDueCOOH => (R1CO) OPPURE (CORDue) + HCl
CH3COCl + CH3COOH => (CH3CO)DueO + HCl
A CH3 proviene dal gruppo acetile, CH3CO-, e l'altro è già presente nell'acido acetico. La scelta di uno specifico cloruro acilico, così come l'acido carbossilico, può portare alla sintesi di un'anidride acida simmetrica o asimmetrica.
Anidridi cicliche
A differenza degli altri acidi carbossilici che richiedono un cloruro acilico, gli acidi bicarbossilici possono condensare nella loro corrispondente anidride. Per questo, è necessario riscaldarli per promuovere il rilascio di H.DueO. Ad esempio, viene mostrata la formazione di anidride ftalica dall'acido ftalico.

Si noti come l'anello pentagonale è completato e l'ossigeno che unisce entrambi i gruppi C = O ne fa parte; questa è un'anidride ciclica. Allo stesso modo, si può apprezzare che l'anidride ftalica è un'anidride simmetrica, poiché sia R1 come RDue sono identici: un anello aromatico.
Non tutti gli acidi bicarbossilici sono in grado di formare la loro anidride, poiché quando i loro gruppi COOH sono ampiamente separati, sono costretti a completare anelli sempre più grandi. L'anello più grande che si può formare è esagonale, più grande di quello in cui non avviene la reazione.
Nomenclatura
Come si chiamano le anidridi? Tralasciando quelle inorganiche, attinenti alle problematiche di ossido, i nomi delle anidridi organiche fin qui spiegate dipendono dall'identità di R1 e RDue; cioè dei suoi gruppi acilici.
Se le due R sono uguali, sostituire semplicemente la parola "acido" con "anidride" nel rispettivo nome dell'acido carbossilico. E se, al contrario, le due R sono diverse, vengono nominate in ordine alfabetico. Pertanto, per sapere come chiamarlo, devi prima vedere se è un'anidride acida simmetrica o asimmetrica.
Il CH3CO)DueO è simmetrico, poiché R1= RDue = CH3. Deriva dall'acido acetico o etanoico, quindi il suo nome è, seguendo la spiegazione precedente: anidride acetica o etanoica. Lo stesso accade con l'anidride ftalica appena citata.
Supponiamo di avere la seguente anidride:
CH3CO (O) COCHDueCHDueCHDueCHDueCHDueCH3
Il gruppo acetile a sinistra proviene dall'acido acetico e quello a destra proviene dall'acido eptanoico. Per denominare questa anidride è necessario nominare i suoi gruppi R in ordine alfabetico. Quindi, il suo nome è: anidride acetica eptanoica.
Applicazioni
Le anidridi inorganiche hanno infinite applicazioni, dalla sintesi e formulazione di materiali, ceramiche, catalizzatori, cementi, elettrodi, fertilizzanti, ecc., Fino a rivestire la crosta terrestre con le sue migliaia di minerali di ferro e alluminio e l'anidride carbonica esalata da organismi viventi.
Rappresentano la fonte di partenza, il punto da cui derivano molti composti utilizzati nelle sintesi inorganiche. Una delle anidridi più importanti è l'anidride carbonica, CODue. È, insieme all'acqua, essenziale per la fotosintesi. E a livello industriale, la SO3 È essenziale poiché da esso si ottiene l'acido solforico convenuto.
Forse l'anidride con più applicazioni e per avere (finché c'è vita) è quella dell'acido fosforico: l'adenosina trifosfato, meglio conosciuta come ATP, presente nel DNA e la "moneta energetica" del metabolismo..
Anidridi organiche
Le anidridi acide reagiscono per acilazione, ad un alcol, formando un estere, un'ammina, dando origine a un'ammide o un anello aromatico.
Esistono milioni di ciascuno di questi composti e centinaia di migliaia di opzioni di acido carbossilico per produrre un'anidride; pertanto, le possibilità sintetiche crescono notevolmente.
Pertanto, una delle applicazioni principali è incorporare un gruppo acile in un composto, sostituendo uno degli atomi o gruppi della sua struttura..
Ogni anidride separata ha le sue applicazioni, ma in termini generali reagiscono tutte in modo simile. Per questo motivo, questi tipi di composti vengono utilizzati per modificare le strutture polimeriche, creando nuovi polimeri; cioè copolimeri, resine, rivestimenti, ecc..
Ad esempio, l'anidride acetica viene utilizzata per acetilare tutti i gruppi OH nella cellulosa (immagine in basso). Con questo, ogni H dell'OH viene sostituito da un gruppo acetile, COCH3.
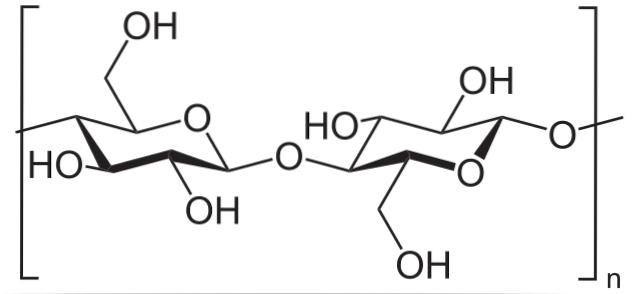
In questo modo si ottiene il polimero acetato di cellulosa. La stessa reazione può essere delineata con altre strutture polimeriche con gruppi NHDue, suscettibile anche all'acilazione.
Queste reazioni di acilazione sono utili anche per la sintesi di farmaci, come l'aspirina (acido acetilesalicilico).
Esempi
Alcuni altri esempi di anidridi organiche sono mostrati per finire. Sebbene non ne venga fatta menzione, gli atomi di ossigeno possono essere sostituiti allo zolfo, dando zolfo o addirittura anidridi fosforose..
-C6H5CO (O) COC6H5: anidride benzoica. Gruppo C6H5 rappresenta un anello benzenico. La sua idrolisi produce due acidi benzoici.
-HCO (O) COH: anidride formica. La sua idrolisi produce due acidi formici.
- C6H5CO (O) COCHDueCH3: anidride propanoica benzoica. La sua idrolisi produce acidi benzoico e propanoico.
-C6HundiciCO (O) COC6Hundici: anidride cicloesancarbossilica. A differenza degli anelli aromatici, questi sono saturi, senza doppi legami.
-CH3CHDueCHDueCO (O) COCHDueCH3: anidride butanoica propanoica.
Anidride succinica

Ecco un altro ciclico, derivato dall'acido succinico, un acido bicarbossilico. Nota come i tre atomi di ossigeno rivelano la natura chimica di questo tipo di composto.
L'anidride maleica è molto simile all'anidride succinica, con la differenza che c'è un doppio legame tra i carboni che formano la base del pentagono..
Anidride glutarica
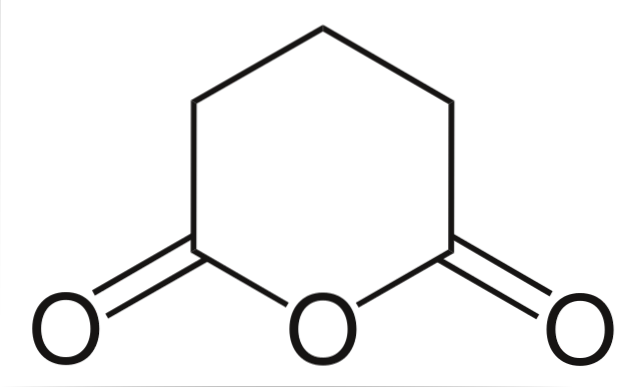
E infine, viene mostrata l'anidride dell'acido glutarico. Questo si distingue strutturalmente da tutti gli altri per essere costituito da un anello esagonale. Ancora una volta, i tre atomi di ossigeno risaltano nella struttura.
Altre anidridi, più complesse, possono sempre essere evidenziate dai tre atomi di ossigeno molto vicini tra loro.
Riferimenti
- The Editors of Encyclopaedia Britannica. (2019). Anidride. Enclyclopaedia Britannica. Estratto da: britannica.com
- Helmenstine, Anne Marie, Ph.D. (8 gennaio 2019). Definizione di anidride acida in chimica. Estratto da: thoughtco.com
- Chemistry LibreTexts. (s.f.). Anidridi. Recupero da: chem.libretexts.org
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10th edizione.). Wiley plus.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Morrison e Boyd. (1987). Chimica organica. (Quinta edizione). Addison-Wesley Iberoamericana.
- Wikipedia. (2019). Anidride acida organica. Estratto da: en.wikipedia.org



Nessun utente ha ancora commentato questo articolo.