
Struttura, funzioni e meccanismo d'azione della Calmodulina
Calmodulin è un termine che significa "proteina modulata dal calcio" e si riferisce a una piccola proteina intracellulare che ha la proprietà di legarsi allo ione calcio (Ca ++) e di mediare molte delle sue azioni intracellulari. L'origine della parola deriva dalla combinazione delle parole inglesi "calcio", "modulato" e "proteina" che, messe insieme, derivano in LIMEcium MODULprotezione atedNEL.
Tra gli elementi minerali che entrano a far parte della costituzione degli organismi animali, il calcio, seguito dal fosforo, è di gran lunga il più abbondante, poiché l'osso è formato dalla deposizione nella sua matrice di grandi quantità di sali minerali formati da questo ione.

Certo, questi sali minerali del calcio sono essenziali per la costituzione e la conformazione del sistema scheletrico dei vertebrati, ma è la forma ionizzata del calcio (Ca ++) in soluzione nei fluidi corporei che acquista un'importanza fisiologica rilevante per la vita di animali, organismi.
Questo catione, con due cariche elettriche positive in eccesso nella sua struttura, può agire come portatore di corrente muovendosi attraverso la membrana cellulare e modificando il suo livello di potenziale elettrico in molte delle cellule eccitabili del corpo, principalmente nel muscolo cardiaco.
Ma di maggiore rilevanza fisiologica è il fatto che molte reazioni di regolazione cellulare innescate da stimoli esterni, come neurotrasmettitori, ormoni o altri fattori fisici o biochimici, sono specie di cascate metaboliche in cui partecipano sequenzialmente diverse proteine, alcune delle quali sono enzimi che richiedono calcio per attivazione o inattivazione.
Si dice quindi in questi casi che il calcio agisca da secondo messaggero in una cascata metabolica destinata ad avere un risultato finale che verrebbe ad essere come la risposta cellulare necessaria a soddisfare un bisogno rilevato ad un altro livello diverso da quello della cellula stessa, e che richiede da lei quella risposta particolare.
Il calcio può agire direttamente sul suo target biochimico per influenzarne l'attività, ma spesso richiede la partecipazione di una proteina con cui deve legarsi per esercitare il suo effetto sulle proteine da modificare. La calmodulina è una di quelle proteine mediatore.
Indice articolo
- 1 Struttura
- 2 Funzioni di calmodulina
- 3 Meccanismo d'azione
- 3.1 Calmodulina e contrazione della muscolatura liscia
- 3.2 Adattamento nei sensori olfattivi
- 4 Calmodulina nelle piante
- 5 Riferimenti
Struttura
La Calmodulina, altamente onnipresente, poiché è espressa in quasi tutti i tipi cellulari degli organismi eucariotici, è una piccola proteina acida con un peso molecolare di circa 17 kDa, la cui struttura è altamente conservata tra le specie..
È una proteina monomerica, cioè costituita da un'unica catena polipeptidica, che alle sue estremità terminali assume la forma di domini globulari uniti da una alfa elica. Ogni dominio globulare ha due motivi noti come la mano EF. EF mano) tipiche delle proteine leganti il calcio.
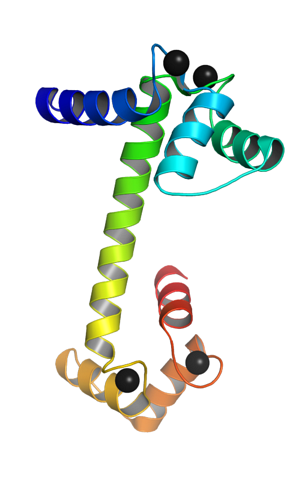
Questi motivi topologici "mano EF" rappresentano una sorta di strutture supersecondarie; sono legati tra loro, in ogni dominio globulare, da una regione di grande flessibilità e in ognuno di essi è presente un sito di legame per Ca ++, che produce 4 siti in totale per ogni molecola di calmodulina.
Il legame di ioni calcio caricati positivamente è reso possibile dalla presenza di residui di amminoacidi con catene laterali caricate negativamente nei siti di legame del calcio della calmodulina. Questi residui sono tre aspartati e un glutammato..
Funzioni della calmodulina
Tutte le funzioni finora conosciute della calmodulina sono inquadrate all'interno di un gruppo di azioni promosse dall'aumento del calcio citosolico prodotto dal suo ingresso dallo spazio extracellulare o dalla sua uscita dai depositi intracellulari: mitocondri e reticolo endoplasmatico.
Molte delle azioni del calcio sono svolte da questo ione agendo direttamente sulle sue proteine bersaglio, che possono avere diversi tipi e funzioni. Alcune di queste proteine non possono essere influenzate direttamente, ma richiedono che il calcio si leghi alla calmodulina ed è proprio questo complesso che agisce sulla proteina influenzata dallo ione..
Si dice che queste proteine bersaglio siano calcio-calmodulina dipendenti e includano dozzine di enzimi, come proteine chinasi, proteine fosfatasi, nucleotidi ciclasi e fosfodiesterasi; tutti coinvolti in una miriade di funzioni fisiologiche tra cui:
- Metabolismo
- Trasporto di particelle
- Mobilità viscerale
- La secrezione di sostanze
- Fecondazione degli ovuli
- Espressione genica
- Proliferazione cellulare
- L'integrità strutturale delle cellule
- Comunicazione intercellulare, ecc.
Tra le protein chinasi calmodulino-dipendenti ci sono: chinasi della catena leggera della miosina (MLCK), chinasi fosforilasi e chinasi Ca ++ / calmodulina I, II e III.
Pertanto, l'informazione codificata dai segnali del calcio (aumento o diminuzione della sua concentrazione intracellulare) viene "decodificata" da questa e da altre proteine leganti il calcio, che convertono i segnali in cambiamenti biochimici; In altre parole, la calmodulina è una proteina intermedia nei processi di segnalazione dipendenti dal calcio.
Meccanismo di azione
La calmodulina è una proteina molto versatile, poiché le sue proteine "bersaglio" sono notevolmente diverse per forma, sequenza, dimensione e funzione. Essendo una proteina che funge da “sensore” per gli ioni calcio, il suo meccanismo d'azione dipende dai cambiamenti indotti nella sua struttura e / o conformazione una volta che si lega a quattro di questi ioni..
I suoi meccanismi d'azione possono essere esemplificati rivedendo brevemente la sua partecipazione a un paio di processi fisiologici come la contrazione della muscolatura liscia viscerale e l'adattamento agli odori subiti dalle cellule ciliate della mucosa olfattiva del naso..
Calmodulina e contrazione della muscolatura liscia
La contrazione dei muscoli scheletrici e cardiaci si attiva quando l'aumento del Ca ++ citosolico raggiunge livelli superiori a 10-6 mol / le questo ione si lega alla troponina C, che subisce modifiche allosteriche che influenzano la tropomiosina. A sua volta, la tropomiosina si sposta ed espone i suoi siti di legame della miosina nell'actina, provocando l'attivazione del processo contrattile.
La troponina C non esiste nella muscolatura liscia e l'aumento di Ca ++ al di sopra del livello indicato ne favorisce il legame con la calmodulina. Il complesso Ca-calmodulina attiva la chinasi della catena leggera della miosina (MLCK), che a sua volta fosforila questa catena leggera, attiva la miosina e innesca il processo contrattile..
L'aumento del Ca ++ avviene attraverso il suo ingresso dall'esterno o la sua uscita dal reticolo sarcoplasmatico per azione dell'inositolo trifosfato (IP3) rilasciato dalla fosfolipasi C nella cascata attivata da recettori accoppiati alla proteina Gq. Il rilassamento si verifica quando il Ca ++, per azione dei trasportatori, viene rimosso dal citosol e ritorna ai suoi siti di origine.
Una differenza importante tra entrambi i tipi di contrazione è che nei muscoli striati (cardiaci e scheletrici) il Ca ++ induce cambiamenti allosterici legandosi con la sua proteina, la troponina, mentre nella muscolatura liscia i cambiamenti prodotti dalla Ca-calmodulina sono covalenti e coinvolgono la fosforilazione della miosina.
Pertanto, una volta terminata l'azione del Ca ++, è necessaria la partecipazione di un altro enzima per rimuovere il fosfato aggiunto dalla chinasi. Questo nuovo enzima è la fosfatasi a catena leggera della miosina (MLCP) la cui attività non dipende dalla calmodulina, ma è regolata da altre vie.
In realtà, il processo contrattile della muscolatura liscia non cessa completamente, ma il grado di contrazione rimane a un livello intermedio per effetto dell'equilibrio delle azioni di entrambi gli enzimi, l'MLCK controllato da Ca ++ e calmodulina, e l'MLCP sottoposti ad altri controlli regolamentari.
Adattamento in sensori olfattivi
La sensazione odorosa si attiva quando vengono attivati i recettori olfattivi situati nelle ciglia delle cellule situate sulla superficie della mucosa olfattiva..
Questi recettori sono accoppiati a una proteina G eterotrimerica nota come "Golf" (proteina G olfattiva), che ha tre subunità: "αolf", "ß" e "γ".
Quando i recettori olfattivi vengono attivati in risposta a un odore, le subunità di questa proteina si dissociano e la subunità "αolf" attiva l'enzima adenil ciclasi, producendo adenosina monofosfato ciclico (cAMP)..
CAMP attiva canali simili a CNG (attivati da nucleotidi ciclici) per calcio e sodio. Questi ioni entrano nella cellula, la depolarizzano e provocano l'inizio di potenziali d'azione la cui frequenza determinerà l'intensità dell'odore..
Il calcio che entra, che tende a depolarizzare la cellula, ha un effetto antagonistico di feedback negativo, un po 'più tardi, legandosi alla calmodulina e tra loro chiudendo il canale ed eliminando lo stimolo depolarizzante, anche se lo stimolo odoroso persiste. Questo è chiamato adattamento del sensore.
Calmodulina nelle piante
Le piante rispondono anche alle differenze nella concentrazione intracellulare di ioni calcio attraverso la proteina calmodulina. In questi organismi, le calmoduline condividono molte caratteristiche strutturali e funzionali con le loro controparti negli animali e nei lieviti, sebbene differiscano in alcuni aspetti funzionali..
Ad esempio, la calmodulina nelle piante si lega a brevi sequenze peptidiche all'interno delle proteine bersaglio, inducendo cambiamenti strutturali che alterano le loro attività in risposta alle variazioni interne del calcio..
Fino a che punto la calmodulina controlli processi analoghi a quelli che si verificano negli animali nelle piante è qualcosa che rimane oggi oggetto di discussione..
Riferimenti
- Brennero B: Musculatur, in: Fisiologia, 6a ed; R Klinke et al (eds). Stoccarda, Georg Thieme Verlag, 2010.
- Ganong WF: Base cellulare e molecolare di fisiologia medica, in: Revisione di fisiologia medica, 25a ed. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JE: Introduzione all'endocrinologia, in: Libro di testo di fisiologia medica, 13a edizione, AC Guyton, JE Hall (a cura di). Philadelphia, Elsevier Inc., 2016.
- Kaup UB, Müller F: Olfactorisches System, In: Physiologie, 4a ed; P Deetjen et al (eds). München, Elsevier GmbH, Urban & Fischer, 2005.
- Korbmacher C, Greger R, Brenner B, Silbernagl S: Die Zelle als Grundbaustein, in: Fisiologia, 6a ed; R Klinke et al (eds). Stoccarda, Georg Thieme Verlag, 2010.
- Zielinski, R. E. (1998). Calmodulina e proteine leganti la calmodulina nelle piante. Revisione annuale della biologia vegetale, 49 (1), 697-725.



Nessun utente ha ancora commentato questo articolo.