
Caratteristiche, sintesi e usi del bromuro di idrogeno (HBr)

Il bromuro di idrogeno, un composto chimico di formula HBr, è una molecola biatomica con un legame covalente. Il composto è classificato come alogenuro di idrogeno, essendo un gas incolore che, disciolto in acqua, forma acido bromidrico saturandosi al 68,85% p / p a temperatura ambiente..
Le soluzioni acquose al 47,6% p / p formano una miscela azeotropica bollente costante che bolle a 124,3 gradi centigradi. Soluzioni meno concentrate e bollenti rilasciano H2O fino a raggiungere la composizione della miscela azeotropica in ebollizione costante..
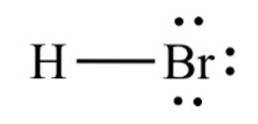
Indice articolo
- 1 Proprietà fisiche e chimiche
- 2 Reattività e pericoli
- 3 Manipolazione e immagazzinamento
- 4 Sintesi
- 5 Usi
- 6 Riferimenti
Proprietà fisiche e chimiche
Il bromuro di idrogeno è un gas incolore a temperatura ambiente con un odore acido e irritante. Il composto è stabile, ma si scurisce gradualmente se esposto all'aria o alla luce come illustrato nella Figura 2 (National Center for Biotechnology Information, S.F.).

Ha un peso molecolare di 80,91 g / mol e una densità di 3,307 g / L, che lo rende più pesante dell'aria. Il gas si condensa producendo un liquido incolore con un punto di ebollizione di -66,73 gradi Celsius.
Continuando a raffreddarsi, il liquido solidifica ottenendo cristalli bianchi, il cui punto di fusione è di -86,82 gradi centigradi con una densità di 2,603 g / ml (Egon Wiberg, 2001). L'aspetto di questi cristalli è illustrato nella figura 3.

La distanza di legame tra il bromo e l'idrogeno è di 1,414 angstrom e la loro energia di dissociazione è di 362,5 kJ / mol..
Il bromuro di idrogeno è più solubile in acqua del cloruro di idrogeno, 221 g possono essere sciolti in 100 ml di acqua a 0 gradi Celsius, che equivale a un volume di 612 litri di questo gas per ogni litro d'acqua. È anche solubile in alcool e altri solventi organici.
In soluzione acquosa (acido bromidrico) le proprietà acide dell'HBr sono dominanti, (come nel caso di HF e HCl) e, nel legame tra idrogeno e alogeno, è più debole nel caso dell'idrogeno bromuro che nell'acido cloridrico.
Pertanto, se il cloro viene fatto passare attraverso il bromuro di idrogeno, si osserva la formazione di vapori marroni caratteristici del bromo molecolare. La reazione che lo spiega è la seguente:
2HBr + Cl2 → 2HCl + Br2
Ciò è indicativo che il bromuro di idrogeno è un agente riducente più forte del cloruro di idrogeno e che l'acido cloridrico è un agente ossidante migliore..
Il bromuro di idrogeno è un acido forte anidro (senza acqua). Reagisce rapidamente ed esotermicamente con basi di tutti i tipi (comprese ammine e ammidi).
Reagisce esotermicamente con i carbonati (inclusi calcare e materiali da costruzione contenenti calcare) e gli idrogenocarbonati per generare anidride carbonica.
Reagisce con solfuri, carburi, boruri e fosfuri generando gas tossici o infiammabili.
Reagisce con molti metalli (inclusi alluminio, zinco, calcio, magnesio, ferro, stagno e tutti i metalli alcalini) per generare gas idrogeno infiammabile.
Rispondi violentemente con:
- anidride acetica
- 2-amminoetanolo
- Idrossido d'ammonio
- fosfuro di calcio
- acido clorosolfonico
- 1,1-difluoroetilene
- etilendiammina
- etileneimmina
- acido solforico fumante
- acido perclorico
- b-propriolattone
- l'OSSIDO del propilene
- perclorato d'argento
- Fosfuro di uranio (IV)
- acetato di vinile
- Carburo di Calcio
- carburo di rubidio
- acetiluro di cesio
- acetilide di rubidio
- boruro di magnesio
- solfato di mercurio (II)
- fosfuro di calcio
- carburo di calcio (scheda tecnica chimica, 2016).
Reattività e rischi
Il bromuro di idrogeno è classificato come composto corrosivo e irritante. È estremamente pericoloso in caso di contatto con la pelle (irritante e corrosivo) e gli occhi (irritante) e in caso di ingestione e inalazione (irritante per i polmoni).
Il composto è conservato in contenitori di gas liquefatto pressurizzato. L'esposizione prolungata al fuoco o al calore intenso può provocare la rottura violenta del contenitore pressurizzato, che può essere rilasciato rilasciando fumi tossici irritanti..
L'esposizione a lungo termine a basse concentrazioni o l'esposizione a breve termine a concentrazioni elevate può provocare effetti nocivi sulla salute dovuti all'inalazione..
La decomposizione termica del bromuro di idrogeno anidro produce gas bromo tossici. Può diventare infiammabile se reagisce rilasciando idrogeno. Il contatto con il cianuro produce gas tossici di acido cianidrico.
L'inalazione provoca grave irritazione del naso e del tratto respiratorio superiore, che può causare lesioni ai polmoni..
L'ingestione provoca ustioni alla bocca e allo stomaco. Il contatto con gli occhi provoca gravi irritazioni e ustioni. Il contatto con la pelle provoca irritazioni e ustioni.
Se questa sostanza chimica in soluzione viene a contatto con gli occhi, sciacquarli immediatamente con grandi quantità di acqua, sollevando di tanto in tanto le palpebre inferiore e superiore..
Le lenti a contatto non devono essere indossate quando si lavora con questa sostanza chimica. Se il tessuto oculare è congelato, consultare immediatamente un medico..
Se il tessuto non è congelato, sciacquare immediatamente e accuratamente gli occhi con abbondante acqua per almeno 15 minuti, sollevando di tanto in tanto le palpebre inferiore e superiore..
Se l'irritazione, il dolore, il gonfiore o la lacrimazione persistono, consultare un medico il prima possibile..
Se questa sostanza chimica in soluzione viene a contatto con la pelle e non causa congelamento, sciacquare immediatamente la pelle contaminata con acqua.
Se questa sostanza chimica viene a contatto con gli indumenti, rimuovere immediatamente gli indumenti e lavare la pelle con acqua.
In caso di congelamento, consultare immediatamente un medico. Non strofinare le aree interessate o risciacquare con acqua. Per evitare ulteriori danni ai tessuti, non tentare di rimuovere gli indumenti congelati dalle aree gelate..
Se vengono inalate grandi quantità di questa sostanza chimica, la persona esposta deve essere immediatamente portata all'aria aperta. Se la respirazione si è interrotta, eseguire la rianimazione bocca a bocca. La vittima dovrebbe essere tenuta al caldo ea riposo e si dovrebbe cercare assistenza medica il prima possibile..
Se questa sostanza chimica in soluzione è stata ingerita, consultare immediatamente un medico.
Manipolazione e stoccaggio
Le bombole di bromuro di idrogeno devono essere conservate in un luogo fresco e ben ventilato. La sua manipolazione deve avvenire con un'adeguata ventilazione. Dovrebbe essere conservato solo quando la temperatura non supera i 52 gradi Celsius.
I contenitori devono essere fissati saldamente in posizione verticale per evitare che cadano o vengano urtati. Inoltre, installare il cappuccio di protezione della valvola, se fornito, saldamente in posizione a mano, nonché conservare separatamente i contenitori pieni e vuoti (praxair inc., 2016).
Quando si maneggia un prodotto sotto pressione, è necessario utilizzare impianti idraulici e attrezzature adeguatamente progettati per resistere alle pressioni incontrate. Non lavorare mai su un sistema pressurizzato e utilizzare un dispositivo di prevenzione del riflusso nella tubazione. I gas possono provocare un rapido soffocamento a causa della carenza di ossigeno.
Conservare e utilizzare con una ventilazione adeguata è importante. Se si verifica una perdita, chiudere la valvola del contenitore e spegnere il sistema in modo sicuro e rispettoso dell'ambiente. Quindi riparare la perdita. Non posizionare mai un contenitore dove possa essere parte di un circuito elettrico.
Guanti di sicurezza in pelle e scarpe adatte devono essere indossati durante la manipolazione delle bombole. Questi devono essere protetti ea tal fine devono essere evitati, trascinati, rotolati o fatti scorrere..
Quando si sposta la bombola, il coperchio della valvola rimovibile deve essere sempre mantenuto in posizione. Non tentare mai di sollevare una bombola dal suo coperchio, che ha il solo scopo di proteggere la valvola..
Quando si spostano le bombole, anche per brevi distanze, utilizzare un carrello (carrello, carrello a mano, ecc.) Predisposto per il trasporto delle bombole.
Un oggetto (ad es. Chiave inglese, cacciavite, leva) non deve mai essere inserito nelle aperture del coperchio, poiché ciò potrebbe danneggiare la valvola e causare una perdita..
Una chiave a nastro regolabile viene utilizzata per rimuovere i cappucci troppo stretti o arrugginiti. La valvola dovrebbe aprirsi lentamente e se ciò è impossibile, smettere di usarla e contattare il proprio fornitore. Naturalmente, la valvola sul contenitore deve essere chiusa dopo ogni utilizzo..
Detto contenitore deve essere mantenuto chiuso anche quando vuoto. Fiamma o calore localizzato non devono mai essere applicati direttamente su nessuna parte del contenitore. Le alte temperature possono danneggiare il contenitore e causare il guasto prematuro del dispositivo di rilascio della pressione, sfiatando il contenuto del contenitore (praxair inc., 2016).
Sintesi
Il gas bromuro di idrogeno può essere prodotto in laboratorio mediante bromurazione della tetralina (1,2,3,4-tetraidronaftalene). Lo svantaggio è che si perde metà del bromo. La resa è di circa il 94% o, a parità di condizioni, il 47% del bromo finisce come HBr.
C10H12 + 4 BrDue → C10H8Br4 + 4 HBr
Il gas bromuro di idrogeno può anche essere sintetizzato in laboratorio facendo reagire l'acido solforico concentrato con il bromuro di sodio..
NaBr (s) + HDueSW4 → HBr (g) + NaHSO4
Lo svantaggio di questo metodo è che gran parte del prodotto viene perso per ossidazione con acido solforico in eccesso per formare bromo e anidride solforosa..
2 HBr + HDueSW4 → BrDue + SWDue + 2 hDueO
Il bromuro di idrogeno può essere preparato in laboratorio dalla reazione tra idrogeno gassoso purificato e bromo. Questa è catalizzata dall'amianto platino e viene effettuata in un tubo di quarzo a 250 ° C.
BrDue + HDue[Pt] → 2 HBr
Il bromuro di idrogeno anidro può anche essere prodotto su piccola scala mediante termolisi del bromuro di trifenilfosfonio in xilene a riflusso..
HBr può essere ottenuto con il metodo del fosforo rosso. Dapprima si aggiunge il fosforo rosso nel reattore ad acqua e successivamente, lentamente, il bromo sotto agitazione e la reazione di acido bromidrico e acido fosforoso, per sedimentazione, filtrazione e la distillazione ottenuta sarà acido bromidrico..
P4+6 BrDue+12 hDueO → 12 HBr + 4 H3PO3
Il bromuro di idrogeno preparato con i metodi di cui sopra può essere contaminato con BrDue, che può essere rimosso facendo passare il gas attraverso una soluzione di fenolo in tetraclorometano o altro solvente adatto a temperatura ambiente, producendo 2, 4, 6-tribromofenolo e generando così più HBr.
Questo processo può essere eseguito anche tramite trucioli di rame ad alta temperatura o garza di rame (idrogeno: bromuro di idrogeno, 1993-2016).
Applicazioni
HBr è utilizzato nella produzione di bromuri organici, come bromuro di metile, bromoetano, ecc., E quelli inorganici, come bromuro di sodio, bromuro di potassio, bromuro di litio e bromuro di calcio, ecc..
Viene anche utilizzato in applicazioni fotografiche e farmaceutiche o per la sintesi di sedativi e anestetici. Inoltre, trova applicazione nell'essiccazione industriale, finissaggio tessile, agenti di rivestimento, trattamenti superficiali e agenti ignifughi..
Il composto viene anche utilizzato per incidere fogli di polisilicio, per la produzione di chip per computer (Interscan Corporation, 2017).
Il bromuro di idrogeno è un buon solvente per alcuni minerali metallici, utilizzato nella raffinazione di metalli di elevata purezza.
Nell'industria petrolifera, viene utilizzato come separazione di composti alcossilici e fenossilici e catalizzatore per l'ossidazione di idrocarburi ciclici e idrocarburi a catena in chetoni, acido o perossido. Viene anche utilizzato in coloranti sintetici e spezie..
Un gas di alta qualità di HBr viene utilizzato per l'incisione e la pulizia della materia prima dei semiconduttori (SHOWA DENKO K.K, n.d.).
Il composto viene utilizzato come reagente analitico nella determinazione di zolfo, selenio, bismuto, zinco e ferro, per la separazione dello stagno dall'arsenico e dall'antimonio. È un catalizzatore di alchilazione e agente riducente utilizzato nella sintesi organica.
Il bromuro di idrogeno può essere utilizzato per la produzione di acido bromidrico. L'acido bromidrico è un acido minerale molto forte, più forte dell'acido cloridrico.
HBr è altamente reattivo e corrosivo per la maggior parte dei metalli. L'acido è un reagente comune in chimica organica, utilizzato per l'ossidazione e la catalisi. È anche efficace nell'estrazione di alcuni minerali metallici (acido bromidrico, 2016).
Riferimenti
- Interscan Corporation. (2017). Strumentazione per il monitoraggio del bromuro di idrogeno e del bromuro di idrogeno. Estratto da gasdetection.com.
- Scheda tecnica chimica. (2016). Estratto da BROMURO DI IDROGENO ANIDRO: cameochemicals.noaa.gov.
- Egon Wiberg, N. W. (2001). Chimica inorganica. Stampa accademica.
- Bromuro di idrogeno. (2016). Estratto da ChemicalBook.
- Idrogeno: bromuro di idrogeno. (1993-2016). Estratto da WebElements.
- Scheda di sicurezza del materiale Bromuro di idrogeno. (2005, 9 ottobre). Estratto da sciencelab.com.
- Centro nazionale per le informazioni sulla biotecnologia. (S.F.). Database composto di PubChem; CID = 260. Estratto da pubchem.ncbi.nlm.nih.gov.
- praxair inc. (2016, 17 ottobre). Bromuro di idrogeno, anidro Scheda di dati di sicurezza P-4605. Estratto da praxair.com.
- SHOWA DENKO K.K. (s.f.). bromuro di idrogeno. Estratto da www.sdk.co.jp.


Nessun utente ha ancora commentato questo articolo.