
Caratteristiche, tipi, funzioni, studi dell'autofagia

Il autofagia è un sistema di degradazione intracellulare che avviene in modo conservato nei lisosomi di tutte le cellule eucariotiche (e nei vacuoli del lievito). La parola è generalmente usata per riferirsi alla degradazione dei componenti del citosol o delle "parti" della cellula che sono "obsolete" o che hanno smesso di funzionare correttamente..
Il termine autofagia è stato coniato nel 1963 alla Rockefeller University da de Duve, che ha anche osservato e descritto i processi di endocitosi cellulare. Letteralmente, la parola autofagia significa "consumarsi", anche se alcuni autori la descrivono come un "auto-cannibalismo".
Questo sistema differisce dalla degradazione mediata dal proteasoma in quanto l'autofagia è in grado di rimuovere organelli intracellulari completi e grandi complessi o aggregati proteici in modo non selettivo..
Nonostante questa fagocitosi non selettiva, diverse indagini hanno dimostrato che l'autofagia ha numerose implicazioni fisiologiche e patologiche. Poiché si attiva durante i periodi di adattamento alla fame, durante lo sviluppo, per l'eliminazione di microrganismi invasori, durante la morte cellulare programmata, per l'eliminazione di tumori, la presentazione di antigeni, ecc..
Indice articolo
- 1 Caratteristiche
- 1.1 Induzione dell'autofagia
- 2 tipi
- 2.1 Macroautofagia
- 2.2 Microautofagia
- 2.3 Autofagia mediata da chaperone
- 3 funzioni
- 3.1 Ruoli nella salute e nello sviluppo
- 4 studi Yoshinori Ohsumi
- 5 Riferimenti
Caratteristiche
L'autofagia, come discusso, è un processo mediato da un organello citoplasmatico noto come lisosoma..
Il processo di "autofagia" inizia con l'incapsulamento dell'organello che verrà degradato da una doppia membrana, formando un corpo membranoso noto come autofagosoma. La membrana dell'autofagosoma si fonde successivamente con la membrana lisosomiale o con un endosoma tardivo.
Ciascuno di questi passaggi tra il sequestro, la degradazione e il rilascio di amminoacidi o altri componenti per il riciclaggio esercita funzioni diverse in diversi contesti cellulari, rendendo l'autofagia un sistema altamente multifunzionale..
L'autofagia è un processo abbastanza controllato, poiché solo i componenti cellulari marcati sono diretti verso questo percorso di degradazione e la marcatura si verifica generalmente durante i processi di rimodellamento cellulare..
Ad esempio, quando una cellula epatica stabilisce una risposta di disintossicazione in risposta a farmaci liposolubili, il suo reticolo endoplasmatico liscio prolifera considerevolmente e quando lo stimolo generato dal farmaco diminuisce, il reticolo endoplasmatico liscio in eccesso viene rimosso dallo spazio citosolico mediante autofagia..
Induzione dell'autofagia
Uno degli eventi che più comunemente innesca i processi autofagici è la fame..
A seconda dell'organismo considerato, diversi tipi di nutrienti essenziali possono innescare questo sistema di "riciclaggio". Nei lieviti, ad esempio, sebbene la mancanza di carbonio in alcuni amminoacidi e acidi nucleici possa indurre l'autofagia, la mancanza di azoto è lo stimolo più efficiente, valido anche per le cellule vegetali.
Sebbene non sia stato completamente compreso, le cellule hanno speciali "sensori" per determinare quando un nutriente o un amminoacido essenziale è in condizioni molto basse e quindi innescare l'intero processo di riciclaggio attraverso i lisosomi.
Nei mammiferi, alcuni ormoni partecipano alla regolazione (positiva o negativa) dell'autofagia nelle cellule appartenenti a determinati organi, come l'insulina, alcuni fattori di crescita o le interleuchine, ecc..
Tipi
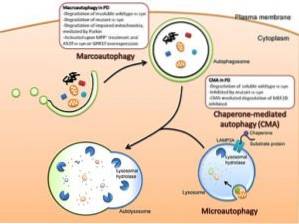
Esistono tre tipi principali di autofagia tra gli eucarioti: macro autofagia, micro autofagia e autofagia mediata da un accompagnatore. Se non diversamente specificato, il termine autofagia si riferisce alla macro autofagia..
Sebbene i tre tipi di autofagia siano morfologicamente diversi, finiscono tutti nel trasporto di sostanze ai lisosomi per la degradazione e il riciclaggio..
Macroautofagia
Questo è un tipo di autofagia che dipende dall'addestramento de novo delle vescicole fagocitiche note come autofagosomi. La formazione di queste vescicole è indipendente dalla formazione di “gemme” di membrana, poiché si formano per espansione.
Nei lieviti, la formazione degli autofagosomi inizia in un particolare sito noto come PAS, mentre nei mammiferi si verificano molti siti diversi nel citosol, probabilmente legati al reticolo endoplasmatico attraverso strutture note come "omegasomi".
La dimensione degli autofagosomi è molto variabile e dipende dall'organismo e dal tipo di molecola o organello che viene fagocitato. Può variare da 0,4-0,9 μm di diametro nel lievito a 0,5-1,5 μm nei mammiferi..
Quando le membrane dell'autofagosoma e del lisosoma si fondono, il contenuto di questi si mescola ed è allora che inizia la digestione dei substrati target dell'autofagia. Questo organello è quindi noto come autolisosoma..
Per alcuni autori, la macroautofagia può essere sottoclassificata, a sua volta, in autofagia indotta e autofagia di base. La macroautofagia indotta viene utilizzata per produrre aminoacidi dopo un periodo prolungato di fame.
La macroautofagia basale si riferisce al meccanismo costitutivo (che è sempre attivo) essenziale per il turnover delle diverse componenti citosoliche e degli organelli intracellulari.
Microautofagia
Questo tipo di autofagia si riferisce al processo in cui il contenuto citoplasmatico viene introdotto nel lisosoma attraverso invaginazioni che si verificano nella membrana di detto organello..
Una volta introdotte nel lisosoma, le vescicole prodotte da queste invaginazioni galleggiano liberamente nel lume fino a quando non vengono lisate e il loro contenuto viene rilasciato e degradato da enzimi specifici..
Autofagia mediata da un accompagnatore
Questo tipo di autofagia è stato segnalato solo per le cellule di mammifero. A differenza della macro-autofagia e della micro-autofagia, dove alcune porzioni citosoliche sono fagocitate in modo non specifico, l'autofagia mediata dagli chaperon è abbastanza specifica, poiché dipende dalla presenza di particolari sequenze pentapeptidiche nei substrati che verranno fagocitati..
Alcuni ricercatori hanno stabilito che questo motivo pentapeptidico è correlato alla sequenza KFERQ e che si trova in oltre il 30% delle proteine citosoliche.
È chiamata "mediata da chaperone" poiché le proteine chaperone sono responsabili di mantenere esposto questo motivo conservato per facilitarne il riconoscimento e impedire che la proteina si ripieghi su di esso..
Le proteine con questo tag vengono traslocate nel lume lisosomiale e lì vengono degradate. Molti dei substrati di degradazione sono enzimi glicolitici, fattori di trascrizione e loro inibitori, proteine leganti il calcio o i lipidi, subunità del proteasoma e alcune proteine coinvolte nel traffico vescicolare..
Come gli altri due tipi di autofagia, l'autofagia mediata da chaperone è un processo regolato a molti livelli, dal riconoscimento dell'etichetta al trasporto e alla degradazione dei substrati all'interno dei lisosomi..
Caratteristiche
Una delle funzioni principali del processo autofagico è l'eliminazione degli organelli senescenti o "obsoleti", che sono etichettati da varie vie per la loro degradazione all'interno dei lisosomi..
Grazie all'osservazione di microfotografie elettroniche di lisosomi in cellule di mammifero, in esse è stata rilevata la presenza di perossisomi e mitocondri..
In una cellula del fegato, ad esempio, la vita media di un mitocondrio è di 10 giorni, dopodiché questo organello viene fagocitato dai lisosomi, dove viene degradato e i suoi componenti vengono riciclati per diversi scopi metabolici..
In condizioni di bassa concentrazione di nutrienti, le cellule possono innescare la formazione di autofagosomi per "catturare" selettivamente porzioni del citosol, così come i metaboliti digeriti in questi autofagosomi possono aiutare le cellule a sopravvivere quando le condizioni esterne sono limitanti dal punto di vista. punto di vista nutrizionale.
Ruoli nella salute e nello sviluppo
L'autofagia ha importanti funzioni nella ristrutturazione delle cellule nel processo di differenziazione, poiché partecipa allo scarto di porzioni citosoliche che non sono richieste in momenti specifici..
Ha anche importanti implicazioni per la salute delle cellule, poiché fa parte dei meccanismi di difesa contro l'invasione di virus e batteri..
Studi di Yoshinori Ohsumi
Yoshinori Ohsumi, un ricercatore giapponese vincitore del Premio Nobel 2016 in Fisiologia e Medicina, ha descritto i meccanismi molecolari dell'autofagia nel lievito mentre studiava il destino metabolico di molte proteine e dei vacuoli di questi organismi unicellulari..
Nel suo lavoro, Ohsumi non solo ha identificato le proteine e le vie coinvolte nel processo, ma ha anche dimostrato come il percorso dell'autofagia sia regolato grazie all'azione di proteine capaci di "contare" diversi stati metabolici..
Il loro lavoro è iniziato con precise osservazioni microscopiche dei vacuoli durante intensi eventi di degrado. I vacuoli sono considerati i siti di stoccaggio di "spazzatura" di lievito e detriti cellulari..
Osservando il lievito con genotipi mutanti difettosi per diversi geni correlati o ipoteticamente correlati all'autofagia (noti come geni ATG), questo ricercatore ei suoi collaboratori sono stati in grado di descrivere il sistema autofagico dei lieviti a livello genetico.
Successivamente, questo gruppo di ricercatori ha determinato le principali caratteristiche genetiche delle proteine codificate da questi geni e ha fornito contributi significativi sulla loro interazione e sulla formazione dei complessi responsabili dell'inizio e dell'esecuzione dell'autofagia nel lievito..
Grazie al lavoro di Yoshinori Ohsumi, oggi comprendiamo meglio gli aspetti molecolari dell'autofagia, nonché le sue importanti implicazioni nel corretto funzionamento delle cellule e degli organi che ci compongono..
Riferimenti
- Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K. e Walter, P. (2015). Biologia molecolare della cellula (6a ed.). New York: Garland Science.
- Klionsky, D. J., & Emr, S. D. (2000). Autofagia come via regolata della degradazione cellulare. Scienza, 290, 1717-1721.
- Mizushima, N. (2007). Autofagia: processo e funzione. Geni e sviluppo, ventuno, 2861-2873.
- Mizushima, Noboru e Komatsu, M. (2011). Autofagia: rinnovamento di cellule e tessuti. Cellula, 147, 728-741.
- Rabinowitz, J. D. e White, E. (2010). Autofagia e metabolismo. Scienza, 330, 1344-1348.



Nessun utente ha ancora commentato questo articolo.