
Storia, struttura, proprietà, usi e rischi dell'antimonio
Il antimonio È un metalloide argentato lucido con una certa tonalità bluastra. Il suo solido è anche caratterizzato da una consistenza molto fragile e traballante. Appartiene al gruppo 15 della tavola periodica, guidato dall'azoto. Dopo il bismuto (e il moscovium), è l'elemento più pesante del gruppo.
È rappresentato dal simbolo chimico Sb. In natura si trova principalmente nei minerali minerali di stibite e ullmannite, le cui formule chimiche sono SbDueS3 e NiSbS, rispettivamente. La sua elevata tendenza a formare solfuri al posto degli ossidi è dovuta alla sua morbidezza chimica.

D'altra parte, l'antimonio è anche fisicamente morbido, presentando una durezza di 3 sulla scala di Mohs. È stabile a temperatura ambiente e non reagisce con l'ossigeno presente nell'aria. Ma quando riscaldato in presenza di ossigeno, forma il triossido di antimonio, SbDueO3.
Allo stesso modo è resistente all'azione degli acidi deboli; ma a caldo viene attaccato dagli acidi nitrico e cloridrico.
L'antimonio ha numerose applicazioni, tra cui è utilizzato in leghe con piombo e stagno, nella fabbricazione di batterie per veicoli, materiali a basso attrito, ecc..
Questo metalloide ha la rara proprietà di aumentare di volume quando si solidifica, consentendo alle sue leghe di occupare completamente lo spazio utilizzato per modellare lo strumento da fabbricare..
Indice articolo
- 1 Storia della sua scoperta
- 1.1 Prima di Cristo
- 1.2 Introduzione del termine
- 1.3 Ottenere
- 2 Struttura dell'antimonio
- 2.1 Allotropia
- 3 Proprietà
- 3.1 Peso atomico
- 3.2 numero atomico
- 3.3 Configurazione elettronica
- 3.4 stati di ossidazione
- 3.5 Descrizione fisica
- 3.6 Punto di fusione
- 3.7 Punto di ebollizione
- 3.8 Densità
- 3.9 Calore di fusione
- 3.10 Calore di vaporizzazione
- 3.11 Capacità termica molare
- 3.12 Elettronegatività
- 3.13 Raggio atomico
- 3.14 Durezza
- 3.15 Stabilità
- 3.16 Isotopi
- 3.17 Conducibilità elettrica e termica
- 3.18 Reattività chimica
- 4 Usi
- 4.1 Leghe
- 4.2 Ignifugo
- 4.3 Campo dell'elettronica
- 4.4 Medicina e veterinaria
- 4.5 Pigmenti e vernici
- 4.6 Altri usi
- 5 Rischi
- 6 Riferimenti
Storia della sua scoperta
AVANTI CRISTO
Ci sono prove che dal 3100 aC il solfuro di antimonio era usato come cosmetico in Egitto. In Mesopotamia, l'attuale Iraq, sono stati trovati resti di un vaso e di un altro manufatto che, presumibilmente, datano tra il 3000 e il 2200 a.C., in cui l'antimonio è stato utilizzato nella sua elaborazione.
Introduzione del termine
Lo studioso romano Plinio il Vecchio (23-79 d.C.) descrisse l'uso dell'antimonio, che chiamò stibio, nell'elaborazione di sette medicine nel suo Trattato di storia naturale. L'alchimista Abu Mussa Jahir Ibn Hayyan (721-815) è accreditato di aver introdotto il termine antimonio per nominare l'elemento.
Ha usato la seguente etimologia: "anti" come sinonimo di negazione e "mono" per solo. Poi ha voluto sottolineare che l'antimonio non si trovava solo in natura. È già noto che fa parte dei minerali solfuri, così come molti altri elementi.
Ottenere
Si ritiene che il naturista greco Pedanius Diascorides abbia ottenuto l'antimonio puro, riscaldando il solfuro di antimonio in un flusso d'aria. Il metallurgista italiano Vannocio Biringucio, nel libro De la Pirotecnia (1540), descrive un metodo per isolare l'antimonio.
Il chimico tedesco Andreas Libavius (1615), utilizzando una miscela fusa di ferro, solfuro di antimonio, sale e tartrato di potassio, ottenne la produzione di un antimonio cristallino.
Il primo rapporto dettagliato sull'antimonio fu realizzato nel 1707 dal chimico francese Nicolas Lemery (1645-1715), nel suo libro Treatise on Antimonio.
Struttura in antimonio
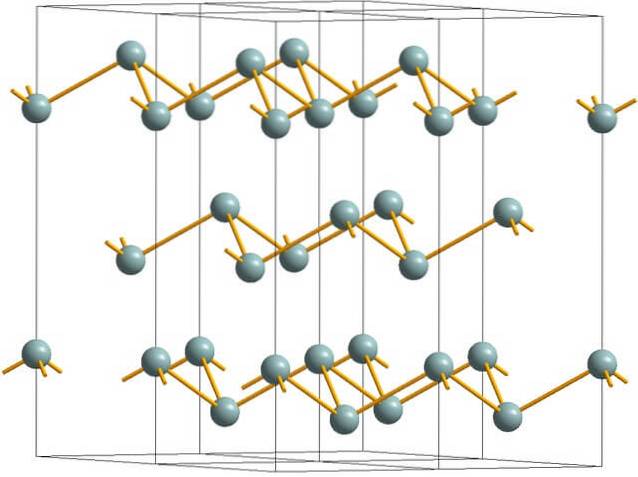
L'immagine in alto mostra la struttura a strati rugosa adottata dagli atomi di arsenico. Tuttavia, anche l'antimonio grigiastro, meglio noto come antimonio metallico, adotta questa struttura. Si dice che sia "rugoso" perché ci sono atomi Sb che salgono e scendono dal piano composto dallo strato.
Questi strati, sebbene siano responsabili dei fotoni che interagiscono con esso brillano lucenti argentei, facendo passare l'antimonio come un metallo, la verità è che le forze che li uniscono sono deboli; quindi i frammenti metallici apparenti di Sb possono essere facilmente macinati e fragili o friabili.
Inoltre, gli atomi Sb negli strati rugosi non sono abbastanza vicini da raggruppare i loro orbitali atomici insieme per creare una banda che consente la conduzione elettrica..
Guardando individualmente una sfera grigiastra, si può vedere che ha tre legami Sb-Sb. Da un piano più alto, si poteva vedere Sb al centro di un triangolo, con tre Sb situati ai suoi vertici. Tuttavia, il triangolo non è piatto e ha due livelli o piani..
La riproduzione laterale di tali triangoli e dei loro legami stabilisce strati rugosi, che si allineano per formare cristalli romboedrici..
Allotropia
La struttura appena descritta corrisponde all'antimonio grigiastro, il più stabile dei suoi quattro allotropi. Gli altri tre allotropi (nero, giallo ed esplosivo) sono metastabili; cioè, possono esistere in condizioni molto difficili.
Non ci sono molte informazioni sulle loro strutture. È noto, tuttavia, che l'antimonio nero è amorfo, quindi la sua struttura è disordinata e intricata..
L'antimonio giallo è stabile al di sotto di -90 ° C, si comporta come un elemento non metallico e si può ipotizzare che sia costituito da piccoli agglomerati di tipo Sb4 (simili a quelli del fosforo); quando riscaldato si trasforma nell'allotropo nero.
E per quanto riguarda l'antimonio esplosivo, consiste in un deposito gelatinoso formatosi sul catodo durante l'elettrolisi di una soluzione acquosa di un alogenuro di antimonio..
Al minimo forte attrito o impatto, il solido morbido rilascia così tanto calore che esplode e si stabilizza quando i suoi atomi si raggruppano nella struttura cristallina romboedrica di antimonio grigiastro..
Proprietà
Peso atomico
121,76 g / mol.
Numero atomico
51.
Configurazione elettronica
[Kr] 4d105sDue5 p3.
Stati di ossidazione
-3, -2, -1, +1, +2, +3, +4, +5.
Descrizione fisica
Argento brillante, solido, fragile, con una superficie squamosa, con una tonalità bluastra. Può anche apparire come una polvere nera.
Punto di fusione
630,63 ºC.
Punto di ebollizione
1.635 ºC.
Densità
-6.697 g / cm3 a temperatura ambiente.
-6,53 g / cm3 allo stato liquido, temperatura uguale o superiore al punto di fusione.
Calore di fusione
19,79 kJ / mol.
Calore di vaporizzazione
193,43 kJ / mol.
Capacità termica molare
25,23 J / mol.K
Elettronegatività
2.05 (scala Pauling).
Radio atomica
140 pm.
Durezza
È un elemento morbido, con una durezza di 3 sulla scala di Mohs e può essere graffiato dal vetro.
Stabilità
È stabile a temperatura ambiente, non subisce ossidazione. Inoltre è resistente all'attacco acido.
Isotopi
Ha due isotopi stabili: 121Sb e 123Sb. Inoltre, ci sono 35 isotopi radioattivi. L'isotopo radioattivo 125Sb è quello con l'emivita più lunga: 2,75 anni. In generale, gli isotopi radioattivi emettono radiazioni β+ e β-.
Conducibilità elettrica e termica
L'antimonio è un cattivo conduttore di calore ed elettricità.
Reattività chimica
Non può spostare l'idrogeno dagli acidi diluiti. Forma complessi ionici con acidi organici e inorganici. L'antimonio metallico non reagisce con l'aria, ma viene rapidamente convertito in ossido nell'aria umida..
Gli alogeni ei solfuri ossidano prontamente l'antimonio, se il processo avviene a temperature elevate.
Applicazioni
Leghe
L'antimonio viene utilizzato in una lega con piombo per realizzare piastre per batterie per auto, migliorando la resistenza delle piastre, nonché le caratteristiche delle cariche..
La lega con piombo e stagno è stata utilizzata per migliorare le caratteristiche delle saldature, così come quella dei proiettili traccianti e dei detonatori a cartuccia. Viene anche utilizzato nelle leghe per il rivestimento di cavi elettrici..
L'antimonio è utilizzato nelle leghe antifrizione, nella produzione di peltro e leghe indurenti a basso contenuto di stagno nella fabbricazione di organi e altri strumenti musicali..
Ha la caratteristica, condivisa con l'acqua, di aumentare di volume quando si condensa; Pertanto, l'antimonio presente nelle leghe con piombo e stagno, riempie tutti gli spazi degli stampi, migliorando la definizione delle strutture realizzate con dette leghe..
Ignifugo
Il triossido di antimonio viene utilizzato per produrre composti ignifughi, sempre in combinazione con ritardanti di fiamma alogenati, bromuri e cloruri..
I ritardanti di fiamma possono reagire con atomi di ossigeno e radicali OH, che inibiscono il fuoco. Questi ritardanti di fiamma sono utilizzati nell'abbigliamento per bambini, nei giocattoli, negli aerei e nei seggiolini auto.
Sono inoltre aggiunti in resine poliestere e compositi in fibra di vetro per articoli utilizzati come coperture per motori di aerei leggeri..
I composti di antimonio utilizzati come ritardanti di fiamma includono: ossicloruro di antimonio, SbOCl; pentossido di antimonio, SbO5; tricloruro di antimonio, SbCl3; e triossido di antimonio, SbO3.
Settore elettronico
Viene utilizzato nella produzione di semiconduttori, diodi, rilevatori a infrarossi medi e nella produzione di transitori. L'antimonio ad elevata purezza, utilizzato nella tecnologia dei semiconduttori, si ottiene riducendo i composti di antimonio con l'idrogeno.
Medicina e veterinaria
I composti di antimonio sono stati usati in medicina fin dall'antichità come emetici e antiprotozoi. Il tartrato di potassio e potassio (tartaro emetico) è stato a lungo utilizzato come antischistosoma; essendo utilizzato, inoltre, come espettorante, diaforetico ed emetico.
I sali di antimonio sono stati utilizzati anche nel condizionamento della pelle dei ruminanti; come aniomalina e tiomalato di antimonio di litio.
L'antimoniato di meglumina è un farmaco utilizzato nel trattamento della leishmaniosi nei focolai esterni degli animali domestici. Tuttavia, i benefici terapeutici erano limitati.
Pigmenti e vernici
I composti di antimonio sono utilizzati nella produzione di vernici e opacizzanti negli smalti. Sono utilizzati anche nei pigmenti vermiglio, giallo e arancio, che sono prodotti della lenta ossidazione dei solfuri di antimonio..
Alcuni dei suoi sali organici (tartrati) sono utilizzati nell'industria tessile per favorire il legame di alcuni coloranti.
Il solfuro di antimonio era usato nell'antico Egitto come cosmetico per scurire gli occhi.
Altri usi
Alcuni sali di antimonio sono usati come agenti di rivestimento per rimuovere le bolle microscopiche che si formano sugli schermi televisivi. Gli ioni di antimonio interagiscono con l'ossigeno, eliminando la sua tendenza a formare bolle.
Il solfuro di antimonio (III) viene utilizzato nelle teste di alcuni fiammiferi di sicurezza. Il solfuro di antimonio viene anche utilizzato per stabilizzare il coefficiente di attrito dei materiali utilizzati nelle pastiglie dei freni delle automobili..
Isotopo 124L'Sb, insieme al berillio, viene utilizzato come sorgente di neutroni, con una media di energia di 24 keV. Inoltre, l'antimonio viene utilizzato come catalizzatore nella produzione di materie plastiche..
Rischi
È un elemento fragile, quindi durante la sua manipolazione può essere prodotta una polvere inquinante dall'ambiente. Nei lavoratori esposti a polvere di antimonio sono state osservate dermatiti, reniti, infiammazioni delle prime vie respiratorie e congiuntivite.
Dopo esposizioni prolungate è stata descritta pneumoconiosi, talvolta associata a alterazioni polmonari ostruttive.
Il triossido di antimonio può causare danni mortali alla funzione cardiaca.
Nelle persone esposte a questo elemento è stata osservata la presenza di infezioni cutanee pustolose transitorie..
L'assunzione continua di basse dosi di questo metallo può causare diarrea, vomito e ulcere gastriche. Allo stesso modo, la concentrazione massima tollerabile nell'aria è di 0,5 mg / m3.
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Manny. (11 marzo 2009). Antimonio giallo e antimonio esplosivo. Recupero da: antimonyproperties.blogspot.com
- Prof. Ernst Cohen e J. C. Van Den Bosch. (1914). L'allotropia dell'antimonio. Atti Royal Acad. Amsterdam. Vol. XVII.
- Wikipedia. (2019). Antimonio. Estratto da: en.wikipedia.org
- Advameg, Inc. (2019). Antimonio. Estratto da: chemistryexplained.com
- Sable Mc'Oneal. (15 settembre 2018). Chimica: proprietà e applicazione dell'antimonio Sb. Recupero da: medium.com


Nessun utente ha ancora commentato questo articolo.