
Struttura chimica, proprietà, sintesi, usi del Pentanon
Il pentanone è un composto organico, appartenente alla famiglia dei chetoni, la cui formula chimica è C5H10O. È ancora uno dei chetoni più semplici e consiste in un liquido incolore con un aroma simile all'acetone. Da questo punto in poi, rispetto al numero di carbonio del loro scheletro, i chetoni mostrano isomerismo di posizione.
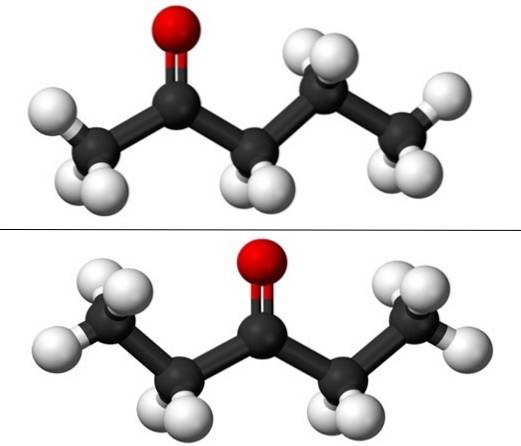
Quando si parla di isomerismo di posizione, ci si riferisce a dove si trova il gruppo carbonile, C = O. Pertanto, il pentanone consiste in realtà di due composti con proprietà fisiche che differiscono leggermente l'uno dall'altro: 2-pentanone e 3-pentanone (immagine in basso). Entrambi sono liquidi, ma i loro punti di ebollizione sono gli stessi, quindi non possono essere separati per distillazione..
Tuttavia, ciascuno dei due pentanoni ha il proprio percorso sintetico, quindi è improbabile che ci sia una miscela di essi; miscela che può essere possibile separare mediante congelamento.
I loro usi sono particolarmente limitati come solventi organici; alternative all'acetone in ambienti dove viene utilizzato ad una temperatura superiore al suo basso punto di ebollizione. Allo stesso modo, sono materiali di partenza per altre sintesi organiche, poiché il loro gruppo C = O può essere ridotto o essere sottoposto ad addizione nucleofila..
Indice articolo
- 1 Struttura chimica
- 1.1 Isomeri di posizione
- 1.2 Interazioni intermolecolari
- 1.3 Cristalli
- 2 Proprietà
- 2.1 Aspetto fisico
- 2.2 Massa molare
- 2.3 Densità
- 2.4 Punto di fusione
- 2.5 Punto di ebollizione
- 2.6 Solubilità in acqua
- 2.7 Pressione di vapore
- 2.8 Punto di infiammabilità
- 2.9 Stabilità
- 3 Sintesi
- 3.1 2-pentanone
- 3.2 3-pentanone
- 4 Usi
- 5 Riferimenti
Struttura chimica
Isomeri di posizione
Nell'immagine abbiamo le strutture molecolari dei due isomeri di posizione per il pentanone, rappresentate da un modello di sfere e barre. Le sfere nere corrispondono agli scheletri di carbonio, quelle bianche agli atomi di idrogeno e quelle rosse agli atomi di ossigeno del gruppo C = O..
2-pentanone
Il 2-pentanone (sopra) ha il gruppo C = O nel secondo carbonio, che è equivalente a quello se fosse nel quarto; cioè, 2-pentanone e 4-pentanone sono equivalenti, poiché è sufficiente ruotarli di 180º in modo che le loro strutture siano le stesse.
A sinistra di C = O c'è un radicale metile, CH3-, e alla sua destra, un radicale propile. Ecco perché questo chetone è anche chiamato (meno comunemente usato) metil propil chetone (MPK). Puoi vedere l'asimmetria di questa struttura a prima vista.
3-pentanone
Il 3-pentanone (in basso) ha il gruppo C = O sul terzo carbonio. Si noti che questo isomero è una versione più grande dell'acetone e che è anche molto simmetrico; i due radicali ai lati del gruppo C = O sono gli stessi: due radicali etilici, CH3CHDue-. Questo è il motivo per cui il 3-pentanone è anche chiamato dietilchetone (o dimetil acetone).
Interazioni intermolecolari
La presenza del gruppo carbonile, sia nel 2-pentanone che nel 3-pentanone, conferisce polarità alla molecola.
Pertanto, entrambi gli isomeri del pentanone sono in grado di interagire tra loro attraverso forze dipolo-dipolo, in cui la più alta densità di carica negativa, δ-, vista in una mappa del potenziale elettrostatico, sarà orientata attorno all'atomo di ossigeno..
Allo stesso modo, le forze di dispersione di Londra intervengono in misura minore tra gli scheletri carbonizzati e idrogenati..
Poiché il pentanone ha un'area molecolare e una massa maggiori rispetto all'acetone, questo contributo si aggiunge al suo momento di dipolo e gli consente di avere un punto di ebollizione più alto (102 ºC> 56 ºC). I due isomeri infatti vaporizzano a 102 ° C; durante il congelamento a temperature diverse.
Cristalli
Probabilmente le simmetrie giocano un ruolo importante nella cristallizzazione. Ad esempio, il punto di fusione del 2-pentanone è -78 ºC, mentre quello del 3-pentanone, -39 ºC.
Ciò significa che i cristalli di 3-pentanone sono più stabili alla temperatura; le sue molecole sono più coesive e richiedono più calore per separarsi nella fase liquida.
Se ci fosse una miscela di entrambi gli isomeri, il 3-pentanone sarebbe il primo a cristallizzare, il 2-pentanone essendo l'ultimo a una temperatura inferiore. Le molecole del 3-pentanone più simmetriche si orientano più facilmente di quelle del 2-pentanone: asimmetriche e allo stesso tempo più dinamiche.
Proprietà
Aspetto fisico
Liquidi incolori con un aroma simile all'acetone.
Massa molare
86,13 g / mol
Densità
0,81 g / mL (3-pentanone)
0,809 g / mL (2-pentanone)
Punto di fusione
-78 ºC (2-pentanone)
-39 ºC (3-pentanone)
Punto di ebollizione
102 ºC (per entrambi gli isomeri)
Solubilità dell'acqua
35 g / L (3-pentanone)
60 g / L (2-pentanone)
Pressione del vapore
35 mmHg (3-pentanone)
270 mmHg (2-pentanone) a 20 ° C
Questi valori non sono utili per confrontare direttamente le pressioni di vapore di entrambi gli isomeri, poiché il primo è riportato senza la temperatura alla quale è stato misurato..
punto d'infiammabilità
12,78 ° C (3-pentanone)
10 ºC (2-pentanone)
Stabilità
I due isomeri del pentanone sono estremamente infiammabili, quindi dovrebbero essere tenuti il più lontano possibile da qualsiasi fonte di calore. I punti di infiammabilità indicano che una fiamma può accendere i vapori di entrambi i pentanoni anche a una temperatura di 10ºC..
Sintesi
Sebbene i due isomeri del pentanone siano fisicamente e chimicamente molto simili, i loro percorsi sintetici sono indipendenti l'uno dall'altro, quindi è improbabile che entrambi siano ottenuti nella stessa sintesi.
2-pentanone
Partendo dal reagente 2-pentanolo, un alcol secondario, può essere ossidato a 2-pentanone utilizzando acido ipocloroso formato in situ, HClO, come agente ossidante. L'ossidazione sarebbe:
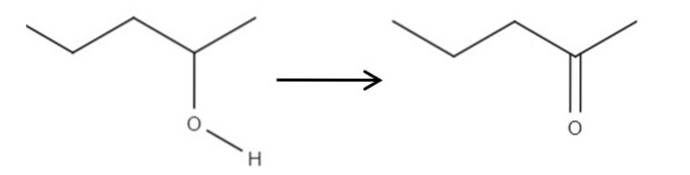
Semplicemente il legame C-OH diventa C = O. Esistono altri metodi per sintetizzare il 2-pentanone, ma di tutti questo è il più facile da capire..
3-pentanone
Il 3-pentanone può essere sintetizzato mediante decarbossilazione chetonica dell'acido propanoico, CH3CHDueCOOH. Questo percorso sintetico produce chetoni simmetrici e consiste in una molecola di CH3COOH perderà il gruppo COOH come CODue, mentre l'altro è il suo gruppo OH nella forma di HDueO:
2CH3CHDueCOOH => CH3CHDueAutoDueCH3 + CODue + HDueO
Un altro percorso un po 'più complesso è far reagire direttamente una miscela di etilene, CHDue= CHDue, CODue e H.Due per formare 3-pentanone.
Applicazioni
A meno che l'applicazione non sia molto rigorosa, si tratta di una sintesi specifica, o è stato anche dimostrato che i due isomeri non producono gli stessi risultati, è irrilevante scegliere tra l'utilizzo del 2-pentanone o del 3-pentanone in uno qualsiasi dei loro usi..
In altre parole, "non importa" se si desidera utilizzare il 2-pentanone o il 3-pentanone come solvente per vernici o resine, o come sgrassante, poiché i criteri più importanti saranno il prezzo e la disponibilità. Il 3-pentanone viene utilizzato nell'industria automobilistica per studiare il comportamento dei gas nei motori a combustione interna.
Riferimenti
- Morrison, R. T. e Boyd, R, N. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Interamericana.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10a edizione.). Wiley plus.
- Wikipedia. (2019). 3-pentanone. Estratto da: en.wikipedia.org
- Centro nazionale per le informazioni sulla biotecnologia. (2019). 2-pentanone. Database PubChem. CID = 7895. Estratto da: pubchem.ncbi.nlm.nih.gov
- Royal Society of Chemistry. (2019). 3-pentanone. Estratto da: chemspider.com
- Professor T. Nalli. (2013). Ossidazione del 2-pentanolo e distillazione del prodotto. Recupero da: course1.winona.edu


Nessun utente ha ancora commentato questo articolo.