
Struttura, proprietà, nomenclatura, rischi e usi dell'anisole
Il anisolo o metossibenzene è un composto organico costituito da un etere aromatico la cui formula chimica è C6H5OCH3. Il suo stato fisico è quello di un liquido incolore, che può presentare colorazioni giallastre. Si riconosce facilmente per il suo caratteristico odore di anice.
Si tratta quindi di un composto volatile e con forze di coesione non molto elevate; caratteristiche tipiche degli eteri leggeri, che vengono conservati in piccoli contenitori sigillati. In particolare, l'anisolo è il più semplice degli alchil aril eteri; cioè quelli con un componente aromatico (Ar) e un altro componente alchilico (R), Ar-O-R.
Gruppo C6H5- viene a denotare Ar, e -CH3 a R, avendo così C6H5-O-CH3. L'anello aromatico e la presenza di -OCH3 In quanto gruppo sostituente chiamato metossi, conferisce all'anisolo una nucleofilia superiore a quella del benzene e del nitrobenzene. Pertanto, funge da molecola intermedia per la sintesi di composti con attività farmacologica..
Il suo caratteristico odore di anice è stato utilizzato per aggiungere l'anisole ai prodotti cosmetici e per l'igiene che richiedono una gradevole profumazione..
Indice articolo
- 1 Struttura dell'anisole
- 1.1 Momento di dipolo
- 1.2 Cristalli
- 2 Proprietà
- 2.1 Aspetto fisico
- 2.2 Odore
- 2.3 Aroma
- 2.4 Massa molecolare
- 2.5 Densità
- 2.6 Densità del vapore
- 2.7 Punto di fusione
- 2.8 Punto di ebollizione
- 2.9 Punto di infiammabilità
- 2.10 Temperatura di autoaccensione
- 2.11 Viscosità
- 2.12 Tensione superficiale
- 2.13 Indice di rifrazione
- 2.14 Solubilità
- 2.15 nucleofilia
- 2.16 Reattività
- 3 Nomenclatura
- 4 Rischi
- 5 Usi
- 5.1 Sintesi organiche
- 5.2 Fragranze
- 6 Riferimenti
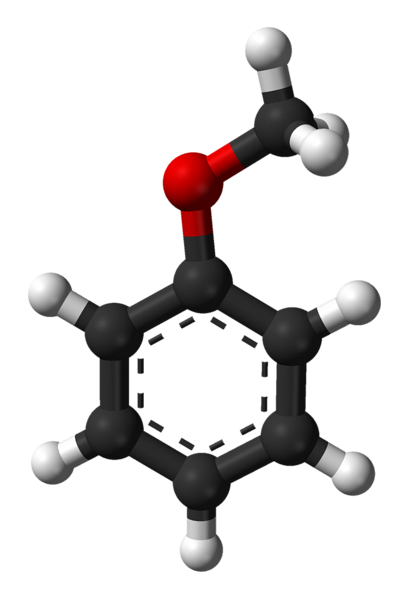
Struttura anisole
L'immagine in alto mostra la struttura molecolare dell'anisole utilizzando un modello di sfere e barre. Si apprezza l'anello aromatico, i cui carboni sono spDue e quindi è piatto, come un foglio esagonale; e attaccato ad esso è il gruppo metossi, il cui carbonio è sp3, ei suoi idrogeni sono sopra o sotto il piano dell'anello.
L'importanza del gruppo -OCH3 nella struttura va oltre la rottura con la geometria piana della molecola: le conferisce polarità e di conseguenza la molecola apolare del benzene acquisisce un momento di dipolo permanente.
Momento di dipolo
Questo momento di dipolo è dovuto all'atomo di ossigeno, che attrae le densità di elettroni di entrambi gli anelli aromatici e metilici. Grazie a ciò, le molecole di anisolo possono interagire attraverso forze dipolo-dipolo; Sebbene non abbia alcuna possibilità di formare legami idrogeno, poiché è un etere (ROR non ha H legato all'ossigeno).
Il suo alto punto di ebollizione (154ºC), certifica sperimentalmente le forti interazioni intermolecolari che governano il suo liquido. Allo stesso modo, sono presenti le forze di dispersione di Londra, dipendenti dalla massa molecolare, e le interazioni π-π tra gli anelli stessi.
Cristalli
La struttura dell'anisole, tuttavia, non gli consente di interagire abbastanza fortemente da adottare un solido a temperatura ambiente (mp = -37ºC). Ciò può anche essere dovuto al fatto che quando le distanze intermolecolari si riducono, le repulsioni elettrostatiche tra gli elettroni degli anelli aromatici vicini iniziano a guadagnare molta forza..
Pertanto, e secondo studi cristallografici, le molecole di anisolo nei cristalli a una temperatura di -173ºC non possono essere disposte in modo tale che i loro anelli siano uno di fronte all'altro; cioè, i loro centri aromatici non sono allineati uno sopra l'altro, ma piuttosto un gruppo -OCH3 è al di sopra o al di sotto di un anello adiacente.
Proprietà
Aspetto fisico
Liquido incolore ma che può avere lievi sfumature paglierine.
Odore
Ha un odore leggermente simile ai semi di anice.
Gusto
Caramella; tuttavia, è moderatamente tossico, quindi questo test è pericoloso.
Massa molecolare
108,140 g / mol.
Densità
0,995 g / mL.
Densità del vapore
3,72 (relativo all'aria = 1).
Punto di fusione
-37ºC.
Punto di ebollizione
154ºC.
punto di accensione
125ºC (tazza aperta).
Temperatura di autoaccensione
475ºC.
Viscosità
0,778 cP a 30 ° C.
Tensione superficiale
34,15 dine / cm a 30 ° C.
Indicatore di rifrazione
1.5179 a 20ºC.
Solubilità
Scarsamente solubile in acqua (circa 1 mg / ml). In altri solventi, come acetone, eteri e alcoli, è tuttavia molto solubile.
Nucleofilia
L'anello aromatico dell'anisolo è ricco di elettroni. Questo perché l'ossigeno, nonostante sia un atomo altamente elettronegativo, contribuisce con gli elettroni della sua nuvola π a delocalizzarli attraverso l'anello in numerose strutture di risonanza. Di conseguenza, più elettroni viaggiano attraverso il sistema aromatico e quindi la sua nucleofilia aumenta..
L'aumento della nucleofilia è stato dimostrato sperimentalmente confrontando la sua reattività, nei confronti delle sostituzioni elettrofile aromatiche, con quella del benzene. Quindi, si evidenzia il notevole effetto del gruppo -OCH.3 sulle proprietà chimiche del composto.
Allo stesso modo, si noti che le sostituzioni elettrofile avvengono nelle posizioni adiacenti (-orto) e opposte (-para) al gruppo metossi; cioè, è direttore orto-para.
Reattività
La nucleofilia dell'anello aromatico dell'anisolo lascia già intravedere la sua reattività. Le sostituzioni possono avvenire sia nell'anello (favorito dalla sua nucleofilia), sia nel gruppo metossi stesso; in quest'ultimo il legame O-CH è rotto3 per sostituire -CH3 da un altro gruppo alchile: O-alchilazione.
Pertanto, in un processo di alchilazione, l'anisolo può accettare un gruppo R (frammento di un'altra molecola) sostituendo una H sul suo anello (C-alchilazione), o sostituendo CH3 del suo gruppo metossi. L'immagine seguente illustra quanto appena detto:
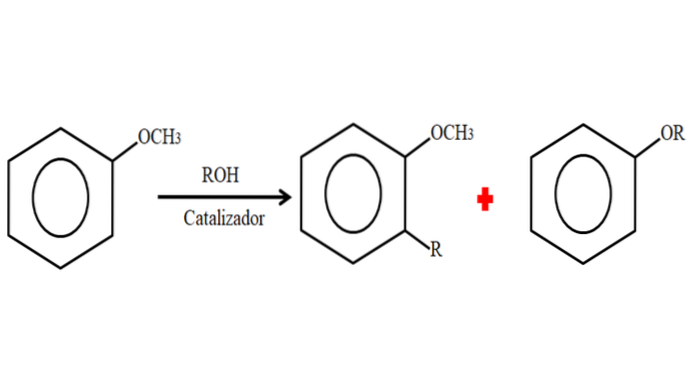
Nell'immagine il gruppo R si trova nella posizione -orto, ma può anche essere nella posizione -para, opposta a -OCH3. Quando avviene la O-alchilazione, si ottiene un nuovo etere con un altro gruppo -OR.
Nomenclatura
Il nome "anisole" è il più conosciuto e accettato, molto probabilmente derivato dal suo odore simile all'anice. Tuttavia, il nome "metossibenzene" è abbastanza specifico, poiché stabilisce immediatamente qual è la struttura e l'identità di questo etere aromatico; questo è il nome governato dalla nomenclatura sistematica.
Un altro nome meno utilizzato ma altrettanto valido è "fenil metil etere", che è disciplinato dalla nomenclatura tradizionale. Questo è forse il nome più specifico di tutti, poiché indica direttamente quali sono le due parti strutturali dell'etere: fenil-O-metile, C6H5-O-CH3.
Rischi
Gli studi medici non sono ancora stati in grado di dimostrare i possibili effetti mortali dell'anisolo nell'organismo a basse dosi. Tuttavia, come quasi tutti i prodotti chimici, provoca irritazione se esposto per troppo tempo e in concentrazioni moderate alla pelle, alla gola, ai polmoni e agli occhi..
Inoltre, a causa della nucleofilia del suo anello, una parte di esso viene metabolizzata e quindi è biodegradabile. Infatti, come risultato di questa proprietà, le simulazioni hanno mostrato che non può concentrarsi negli ecosistemi acquosi poiché i suoi organismi prima lo degradano; e quindi, fiumi, laghi o mari possono accumulare anisole.
Nei suoli, data la sua volatilità, evapora rapidamente ed è portato via dalle correnti d'aria; stando così le cose, non influisce neppure notevolmente sulle masse vegetali o sulle piantagioni.
D'altra parte atmosfericamente reagisce con i radicali liberi, e quindi non rappresenta un rischio di contaminazione per l'aria che respiriamo..
Applicazioni
Sintesi organiche
Dall'anisolo si possono ottenere altri derivati mediante sostituzione elettrofila aromatica. Ciò ne consente l'utilizzo come intermedio per la sintesi di farmaci, pesticidi e solventi, ai quali si desidera aggiungere le sue caratteristiche. Le vie sintetiche possono consistere principalmente in C-alchilazione o O-alchilazione.
Fragranze
Oltre al suo utilizzo per la sintesi organica, può essere utilizzato direttamente come additivo per creme, unguenti e profumi, incorporando fragranze di anice a tali prodotti..
Riferimenti
- Morrison, R. T. e Boyd, R, N. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Interamericana.
- Carey F. A. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10a edizione.). Wiley plus.
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Anisole. Database PubChem, CID = 7519. Estratto da: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Anisole. Estratto da: en.wikipedia.org
- Pereira, Cynthia C. M., de la Cruz, Marcus H. C., & Lachter, Elizabeth R. (2010). Alchilazione in fase liquida di anisolo e fenolo catalizzata da fosfato di niobio. Journal of the Brazilian Chemical Society, 21 (2), 367-370. dx.doi.org/10.1590/S0103-50532010000200025
- Seidel R. W. e Goddard R. (2015). Anisole a 100 K: la prima determinazione della struttura cristallina. Acta Crystallogr C Struct Chem.Aug; 71 (Pt 8): 664-6. doi: 10.1107 / S2053229615012553
- Formulazione chimica. (2018). Metossibenzene Estratto da: formulacionquimica.com
Nessun utente ha ancora commentato questo articolo.