
Fondazione, preparazione e usi dell'agar Müeller Hinton
Il Agar Müeller Hinton È un terreno nutritivo solido e non selettivo, composto da infuso di carne, peptone di caseina acida, amido, agar e acqua distillata. Questo terreno consente un'eccellente crescita microbica della maggior parte dei batteri a crescita rapida.
È stato originariamente creato da John Howard Müeller e Jane Hinton per isolare batteri nutrizionalmente esigenti come Neisseria gonorrhoeae Y Neisseria meningitidis. Tuttavia, per le sue caratteristiche, si è rivelato ideale per lo studio della suscettibilità agli antibiotici, fornendo risultati affidabili e riproducibili..
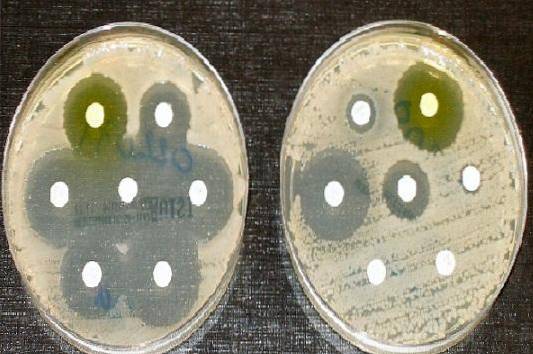
Pertanto, l'agar Müeller Hinton è il terreno di coltura accettato dal Clinical and Laboratory Standards Institute (CLSI) e dal Comitato europeo sui test di suscettibilità antimicrobica, per l'esecuzione del test di suscettibilità antimicrobica con il metodo di diffusione del disco di Kirby e Bauer.
Indice articolo
- 1 Razionale
- 2 Preparazione
- 3 usi
- 3.1 La tecnica dell'antibiogramma
- 3.2 Posizionamento strategico dei dischi su agar Müeller Hinton
- 4 Cause di risultati errati
- 5 Limitazione
- 6 Controllo di qualità
- 7 Riferimenti
Base
Essendo un terreno nutritivo non selettivo, è ottimo per la crescita della maggior parte dei batteri patogeni..
D'altra parte, la sua semplice composizione rende le sostanze facilmente diffondibili su di esso, caratteristica essenziale per il test di suscettibilità con il metodo della diffusione del disco..
Un'altra delle sue caratteristiche è che contiene una bassa quantità di inibitori, che consente di valutare efficacemente sulfonamidi, trimetoprim e tetracicline..
Tuttavia, si deve tenere presente che il supporto deve soddisfare determinate condizioni per assicurarne il corretto funzionamento, tra cui:
La regolazione del pH, la profondità dell'agar e la concentrazione appropriata di timina, timidina, Ca++, Mg++ e Zn++.
Devi anche sapere che la metodologia è standardizzata e quindi tutti i parametri devono essere rispettati, come ad esempio:
La concentrazione dell'inoculo, la concentrazione e la conservazione dei dischi antibiotici, il posizionamento del numero appropriato di dischi sull'agar, la distanza tra un disco e l'altro, il posizionamento strategico di alcuni antibiotici, l'atmosfera, la temperatura e il tempo di incubazione.
Preparazione
Pesare 37 g di terreno Müeller Hinton disidratato e sciogliere in 1 litro di acqua distillata. Riscaldare il terreno mescolando per favorire la dissoluzione. Bollire per 1 minuto.
Sterilizzare in autoclave a 121 ° C per 15 minuti. Quando si rimuove dall'autoclave, il pallone deve essere posto a bagnomaria a 50 ° C per raffreddare. Versare da 25 a 30 ml in piastre Petri sterili di 10 cm di diametro.
Le lastre dovrebbero avere uno spessore medio di 4 mm (ideale), essendo consentito un range di 3-5 mm.
Se si desidera preparare l'agar sangue utilizzando l'agar Müeller Hinton come base, versare il 5% di sangue di agnello sterile e defibrinato prima di servire sulle piastre..
Il pH finale del mezzo dovrebbe essere compreso tra 7,2 e 7,4.
Investire e conservare in frigorifero, fino al momento dell'uso. Attendere che la piastra raggiunga la temperatura ambiente prima dell'uso.
Il colore del terreno preparato è beige chiaro.
Applicazioni
Utilizzato per eseguire l'antibiogramma o il test di sensibilità agli antibiotici per la maggior parte dei patogeni non esigenti a crescita rapida.
Se l'agar è integrato con sangue, viene utilizzato per eseguire l'antibiogramma di microrganismi esigenti come: Streptococcus pneumoniae, Haemophilus sp, Neisseria meningitidis, tra gli altri. È stato anche usato per isolare Legionella pneumophila.
Tecnica dell'antibiogramma
Prima di eseguire l'antibiogramma, è necessario preparare una soluzione batterica equivalente a 1,5 x 10.8 cellule.
Per questo, vengono prelevate da 3 a 4 colonie della coltura pura e sospese in un brodo di tripticasi di soia o in brodo Müeller Hinton, incubate da 2 a 6 ore e la concentrazione viene regolata con soluzione salina sterile, confrontandola con uno standard Mac Farland di 0,5 %.
Se sono microrganismi esigenti, le colonie possono essere sospese direttamente fino alla concentrazione dello 0,5% di Mac Farland. Successivamente, la piastra Müeller Hinton viene seminata con un tampone impregnato con la soluzione batterica preparata..
Per fare ciò, il tampone viene immerso nella soluzione e quindi il liquido in eccesso viene rimosso premendo contro le pareti della provetta. Subito dopo si passa il tampone su tutta la superficie senza lasciare intatti punti, quindi si ruota leggermente la piastra e si semina nuovamente. L'operazione viene ripetuta altre 2 volte.
Lasciar riposare per 10 minuti e poi attaccare i dischi antibiotici con una pinza sterile, lasciando uno spazio di 24 mm tra di loro. Dopo aver posizionato ogni disco sull'agar, premere leggermente ogni disco con la pinza per assicurarsi che aderiscano bene..
Al termine del processo, la piastra viene capovolta e incubata a 35-37 ° C in aerobiosi per 16-18 ore. Se è un microrganismo esigente, può giustificare la microaerofilia e se l'antibiogramma contiene dischi di oxacillina, deve essere letto dopo 24 ore..
Un righello viene utilizzato per misurare il diametro di ogni alone. I risultati devono essere registrati in mm. Successivamente i valori ottenuti vengono correlati alle tabelle dei cut point pubblicate dal manuale CLSI in vigore..

Segnala come sensibile (S), intermedio (I) o resistente (R), a seconda dei casi.
Gli antibiotici vengono selezionati in base al microrganismo isolato e al tipo di infezione che sta causando.
A volte il posizionamento strategico degli antibiotici deve essere preso in considerazione per mostrare modelli fenotipici di resistenza.
Posizionamento strategico dei dischi su agar Müeller Hinton
Per gli enterobatteri, il disco di acido clavulanico deve essere posizionato contro le cefalosporine di 3a e 4a generazione. Un allargamento a forma di uovo indica che il ceppo è un produttore di beta-lattamasi a spettro esteso (ESBL). Ciò significa che il paziente non deve essere trattato con cefalosporine..
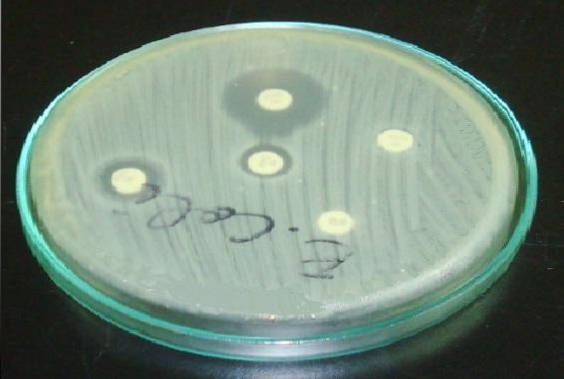
Nello Staphylococcus è importante posizionare il disco di eritromicina o azitromicina davanti al disco di clindamicina (D-test).
Un alone resistente nell'eritromicina e un appiattimento nell'alone della clindamicina indicano che il ceppo possiede una resistenza alla clindamicina inducibile dal ceppo (ICR). Ciò significa che un trattamento con clindamicina non sarà efficace..
Per cercare ceppi AMP C inducibili nelle Enterobacteriaceae e in alcuni bastoncini Gram negativi non fermentanti, i dischi di ceftazidima, cefoxitina o piperacillina tazobactan vengono affrontati contro un disco di imipenem, a una distanza di 27 mm.
Un alone appiattito in uno dei dischi rivolti verso imipenem indica la presenza di AMP C inducibile.
Per la ricerca del C-AMP costitutivo, un disco di cloxacillina da 500 µg viene affrontato con ceftazidima (30 µg) e con cefotaxime (30 µg), a una distanza di 25 mm. Un alone allargato in una qualsiasi delle cefalosporine indica positività.
Il disco di cloxacillina può anche essere sostituito da un disco da 9 mm di carta da filtro Whatman n. 6 impregnato con acido fenilborico (400 µg) con una distanza di 18 mm. Viene interpretato come il precedente.
Infine, per studiare la produzione di metallobetalattamasi soprattutto in Pseudomonas aeruginosa, Viene utilizzato un disco impregnato con 10 µl di acido etilendiamminotetraacetico (EDTA 750 µg) e acido tioglicolico (SMA 300 µg), rivolto verso i dischi di imipenem e meropenem, a una distanza di 15 mm.
Il test è positivo se si verifica un allargamento degli aloni di imipenem o meropenem verso il disco EDTA / SMA. Questo risultato deve essere confermato dal test Hodge modificato..
Questo metodo consiste nell'inoculare un ceppo di Escherichia coli ATCC 25922 sulla targa Müeller Hinton. Un disco di imipenem viene posto al centro della piastra e quindi viene eseguita una striscia dal disco verso la periferia con la tensione di P. aeruginosa sospettoso. È possibile testare fino a 4 ceppi per piastra.
Il test sarà positivo se è presente una zona di distorsione dell'alone dell'imipenem attorno alla smagliatura.
Cause di risultati errati
-I dischi antibiotici mal conservati possono produrre false resistenze. Ad esempio, il disco di oxacillina è molto vulnerabile ai cambiamenti di temperatura..
-Un pH del mezzo inferiore a quello indicato (acido) produce aloni più piccoli in aminoglicosidi e macrolidi (rischio di falsa resistenza) e aloni più grandi in penicillina, tetraciclina e novobiocina (rischio di falsa sensibilità).
-Se il pH è superiore a quello indicato (alcalino) gli effetti sopra descritti sono invertiti.
-I terreni con concentrazioni elevate di timina e timidina hanno un'influenza riducendo significativamente gli aloni di inibizione dei sulfonamidi e del trimetoprim..
-Alte concentrazioni di calcio e magnesio producono una falsa resistenza di aminoglicosidi, polimixina B e tetracicline contro ceppi di Pseudomonas aeruginosa.
-Basse concentrazioni di calcio e magnesio producono false sensibilità di aminoglicosidi, polimixina B e tetracicline contro ceppi di Pseudomonas aeruginosa.
-La presenza di zinco influisce sui risultati dei dischi carbapenemici (imipenem, meropenem ed ertapenem).
-Lo spessore del supporto inferiore a 3 mm produrrà risultati di falsa sensibilità, mentre lo spessore superiore a 5 produrrà falsa resistenza.
-La mobilizzazione dei dischi nell'antibiogramma darà aloni deformati, poiché lo scarico degli antibiotici è immediato.
- Inoculi molto deboli influenzano i risultati, in quanto non ci sarà una crescita uniforme o confluente nell'agar, condizione necessaria per poter misurare gli aloni di inibizione, oltre al fatto che gli aloni possono dare più grandi del normale.
-Gli inoculi eccessivamente caricati possono dare aloni più piccoli del normale.
-Il mancato rispetto della distanza tra i dischi causa la sovrapposizione di un alone con un altro e questi non possono essere letti correttamente.
-Incubare con CODue aumenta la dimensione degli aloni dei dischi di tetraciclina e meticillina.
-Incubare a temperature inferiori a 35 ° C produce aloni più grandi.
-L'aggiunta di sangue riduce la dimensione dell'alone sulfonamidico.
Limitazione
La sensibilità di un antibiotico dimostrata nell'antibiogramma contro un microrganismo (in vitro) non garantisce che funzioni in vivo.
QA
Per sapere se il terreno contiene la quantità adeguata di timina, è necessario coltivare un ceppo Enterococcus faecalis ATCC 29212 e testare la suscettibilità al trimetoprim sulfametossazolo (SXT), deve fornire un alone uguale o> 20 mm per essere soddisfacente.
Riferimenti
- "Agar Müller-Hinton". Wikipedia, l'enciclopedia libera. 16 novembre 2018, 12:23 UTC. 27 gennaio 2019, 04:22
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott Microbiological Diagnosis. 12 ed. Editoriale Panamericana S.A. Argentina.
- Cona E. Condizioni per un buon studio di suscettibilità mediante test di diffusione in agar. Rev Chil Infect, 2002; 19 (2): 77-81
- Laboratorio Difco Francisco Soria Melguizo. Agar Müeller Hinton con il 5% di sangue di pecora. Disponibile su: http://f-soria.es
- BD Müeller Hinton II Agar Laboratory. 2017, disponibile su: .bd.com
- Britannia Laboratories. Agar Müeller Hinton. 2015 Disponibile su: britanialab.com
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosi microbiologica. 5a ed. Editoriale Panamericana S.A. Argentina.
- Betalattamasi di tipo Martínez-Rojas D. AmpC: generalità e metodi per la rilevazione fenotipica. Rev. Soc. Ven. Microbiol. 2009; 29 (2): 78-83. Disponibile su: scielo.org.
- Perozo A, Castellano M, Ling E, Arraiz N. Rilevamento fenotipico di metallobetalattamasi in isolati clinici di Pseudomonas aeruginosa. Kasmera, 2012; 40 (2): 113-121. Disponibile su: scielo.org.

Nessun utente ha ancora commentato questo articolo.