
Struttura, proprietà, usi dell'acetato di alluminio (Al (CH3COO) 3)

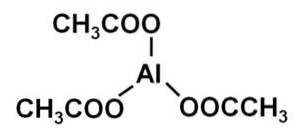
Il acetato di alluminio è un composto organico formato da uno ione alluminio Al3+ e tre ioni acetato CH3COO-. La sua formula chimica è Al (CH3COO)3. È anche noto come triacetato di alluminio. È un solido bianco leggermente igroscopico e solubile in acqua..
Per ottenere questo composto è necessario utilizzare condizioni totalmente anidre, cioè prive di acqua, altrimenti il diacetato di alluminio Al (OH) (CH3COO)Due.
Le soluzioni di acetato di alluminio hanno proprietà antibatteriche e antimicotiche, motivo per cui dal 19 ° secolo sono state utilizzate per trattare le infezioni soprattutto delle orecchie..
La più nota è la soluzione di Burow, ideata da un medico tedesco. Tuttavia, il suo utilizzo ha occasionalmente portato a danni all'orecchio medio..
Questa soluzione è stata utilizzata anche per trattare problemi della pelle come prurito ed eruzioni cutanee. È anche usato come un sollievo dalle scottature solari.
L'acetato di alluminio e i suoi derivati vengono utilizzati per ottenere strutture o particelle molto piccole di allumina AlDueO3. Queste strutture o nanoparticelle possono essere sotto forma di foglie, fiori o nanotubi..
Indice articolo
- 1 Struttura
- 2 Nomenclatura
- 3 Proprietà
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Solubilità
- 3.4 Proprietà chimiche
- 3.5 Altre proprietà
- 4 Ottenimento
- 5 Usi in medicina
- 5.1 Infezioni dell'orecchio
- 5.2 Malattie della pelle
- 6 Altri usi
- 6.1 Uso interrotto
- 7 effetti nocivi
- 8 Riferimenti
Struttura
Il triacetato di alluminio è costituito da un catione di alluminio Al3+ e tre anioni acetato CH3COO-. È il sale di alluminio dell'acido acetico CH3COOH.
L'alluminio è legato agli anioni acetato attraverso il loro ossigeno. In altre parole, è attaccato a tre ossigeni. Queste giunzioni sono ioniche.
Nomenclatura
- Acetato di alluminio
- Triacetato di alluminio
- Etanoato di alluminio
- La soluzione di Burow (traduzione dall'inglese La soluzione di Burow): È una soluzione di acetato di alluminio.
Proprietà
Stato fisico
Bianco fisso.
Peso molecolare
204,11 g / mol
Solubilità
Solubile in acqua.
Proprietà chimiche
In soluzione acquosa, il triacetato di alluminio si dissolve e tende a formare diacetato Al (OH) (CH3COO) e talvolta monoacetato di Al (OH)Due(CH3COO). Tutto dipende dal pH e dalla quantità di acido acetico CH3COOH presente nella soluzione.
Al (CH3COO)3 + HDueO ⇔ Al (OH) (CH3COO)Due + CH3COOH
Al (CH3COO)3 + 2 hDueO ⇔ Al (OH)Due(CH3COO) + 2 CH3COOH
Altre proprietà
L'acetato di alluminio è leggermente igroscopico, cioè tende ad assorbire l'acqua dall'aria.
Ottenere
L'acetato di alluminio si ottiene preferibilmente in condizioni rigorosamente anidre, cioè in totale assenza di acqua. Ciò include anche l'assenza di aria, poiché può contenere umidità..
Riscaldare una miscela di acido acetico glaciale CH3COOH e anidride acetica (CH3CO)DueOppure in condizioni tali da poter eliminare tutta l'acqua presente. A questa miscela calda viene aggiunto cloruro di alluminio AlCl.3 solido anidro (senza acqua).
Un solido bianco di Al (CH3COO)3.
AlCl3 + 3 CH3COOH → Al (CH3COO)3 + 3 HCl
La totale assenza di acqua è importante per evitare la formazione di sali di monoacetato di alluminio Al (OH)Due(CH3COO) e diacetato di alluminio Al (OH) (CH3COO)Due.
Può anche essere ottenuto dalla reazione di idrossido di alluminio Al (OH)3 e acido acetico CH3COOH.
Usi in medicina
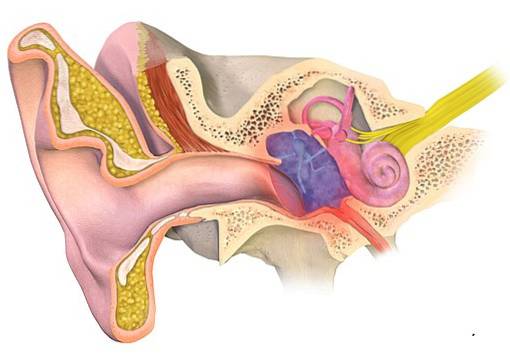
Infezioni dell'orecchio
L'acetato di alluminio è stato utilizzato dal 19 ° secolo per trattare l'otite, un'infiammazione dell'orecchio esterno o medio solitamente accompagnata da infezione. Il suo utilizzo è dovuto al suo effetto antibatterico e antimicotico.
È stato utilizzato sotto forma di una soluzione di acetato di alluminio al 13%, originariamente ideata dal medico tedesco Karl August von Burow, motivo per cui si chiama soluzione di Burow..
È stato scoperto che inibisce la crescita di microrganismi comunemente presenti nell'otite media o esterna, come l'otite media. Pseudomonas aeruginosa, il Staphylococcus aureus e il Proteus mirabilis.

Tuttavia, c'è chi segnala che queste soluzioni possono essere dannose per l'orecchio. Alcuni studi sugli animali studiano i suoi effetti tossici sull'orecchio, ma hanno riportato risultati contrastanti..
Alcuni ricercatori consigliano di non utilizzare acetato di alluminio quando la membrana timpanica è perforata, poiché è stato osservato che esercita un effetto infiammatorio sull'orecchio medio.
Malattie della pelle
La soluzione di Burow è usata come antisettico, astringente e come soluzione topica per trattare gravi eruzioni cutanee, dermatiti, infiammazioni, prurito, bruciore e scottature solari. Ha un effetto calmante e riduttore di irritazioni.
Altri usi
Il triacetato di alluminio ei suoi derivati sono usati per molti esperimenti chimici qualitativi e quantitativi.
Un derivato del triacetato di alluminio, Al (OH) (CH3COO)Due detto anche idrossido di alluminio acetato, è utilizzato come precursore per ottenere nanostrutture di gamma-allumina (γ-AlDueO3).
In questo caso, precursore significa che le nanostrutture γ-Al sono preparate da diacetato di alluminio (ottenuto in modo particolare).DueO3, e questo si ottiene riscaldandolo a temperature molto elevate.
Le nanostrutture sono particelle molto piccole che possono essere osservate solo attraverso microscopi speciali come i microscopi elettronici. Con l'acetato di alluminio come precursore, sono state ottenute nanostrutture γ-AlDueO3 simile a foglie, fiori, fibre e persino nanotubi.

Uso interrotto
All'inizio del XX secolo, l'acetato di alluminio era usato come conservante in alimenti come le salsicce in scatola.
Una soluzione di acetato di alluminio è stata preparata mescolando solfato di alluminio AlDue(SW4)3, carbonato di calcio CaCO3, acido acetico CH3COOH e acqua HDueOppure, ed è stato aggiunto al cibo.
Quando questa soluzione viene a contatto con la carne, l'alluminio si fissa nei suoi costituenti sotto forma di un composto insolubile in acqua bollente, ma che si dissolve nei succhi gastrici circa l'80%.
Già nel 1904 si sapeva che i sali di alluminio rallentano la digestione, sia nello stomaco che nell'intestino. Pertanto è una pratica indesiderabile aggiungere soluzioni di acetato di alluminio al cibo in scatola..

Effetti dannosi
Poiché esistono studi che riportano che l'acetato di alluminio può essere tossico, sono stati effettuati test in cui i topi di laboratorio sono stati iniettati con acetato di alluminio.
I risultati indicano che questo composto provoca danni alla colonna vertebrale di detti animali, nonché danni ai cromosomi e allo sperma degli animali. In altre parole è genotossico.
Questo ti avverte dei potenziali rischi per la salute che potrebbero essere causati dalla sovraesposizione all'acetato di alluminio e alla cura che dovrebbe essere presa durante l'utilizzo..
Riferimenti
- Mac-Kay Chace, E. (1904). L'uso di acetato di alluminio di base come conservante nella salsiccia. Giornale della American Chemical Society 1904, 26, 6: 662-665. Recuperato da pubs.acs.org.
- Hood, G.C. e Ihde, A.J. (1950). Acetati e propionati di alluminio: loro preparazione e composizione. Giornale della American Chemical Society 1950, 72, 5: 2094-2095. Recuperato da pubs.acs.org.
- Pitaro, J. et al. (2013). Ototossicità della soluzione otica di acetato di alluminio / benzenetonio cloruro nel modello animale di cincillà. Laringoscopio, 2013; 123 (10): 2521-5. Recupero da ncbi.nlm.nih.gov.
- Thorp, M.A. et al. (2000). La soluzione di Burow nel trattamento dell'otite media suppurativa cronica della mucosa attiva: determinazione di un'efficace diluizione. The Journal of Laryngology & Otology, giugno 2000, Vol.114, pp. 432-436. Recupero da ncbi.nlm.nih.gov.
- D'Souza, il signor P. et al. (2014). Valutazione della genotossicità dell'acetato di alluminio nel midollo osseo, nelle cellule germinali maschili e nelle cellule epatiche fetali di topi albini svizzeri. Mutation Research 766 (2014) 16-22. Recupero da ncbi.nlm.nih.gov.
- Basale, Y. et al. (2015). Gli effetti delle soluzioni topiche di Burow e Castellani sulla mucosa dell'orecchio medio dei ratti. J. Int Adv Otol 2015; 11 (3): 253-6. Recupero da advancedotology.org.
- NOI. Biblioteca nazionale di medicina. (2019). Acetato di alluminio. Recupero da pubchem.ncbi.nlm.nih.gov.
- Buttaravoli, P. e Leffler, S.M. (2012). Sunburn. Cosa fare. In Minor Emergencies (Terza Edizione). Recupero da sciencedirect.com.
- Thompson, E. e Kalus, A. (2017). Reazioni cutanee acute e infezioni batteriche. Trattamento. Nel manuale di viaggio e medicina tropicale (quinta edizione). Recupero da sciencedirect.com.
- Kim, T. et al. (2010). Sintesi morfologica controllabile di nanostrutture gamma-allumina tramite un percorso idrotermale ionico assistito da liquido. Crystal Growth & Design, Vol.10, No.7, 2010, pagg. 2928-2933. Recuperato da pubs.acs.org.
- Rajala, J.W. et al. (2015). Fibre ceramiche di ossido di alluminio cavo elettrofilate Core-Shell. Fibre 2015, 3, 450-462. Recuperato da mdpi.com.



Nessun utente ha ancora commentato questo articolo.