
50 esempi di acidi e basi

Ce ne sono centinaia esempi di acidi e basi che può essere trovato in tutti i rami della chimica, ma che nel suo insieme sono separati in due grandi famiglie: inorganica e organica. Gli acidi inorganici sono generalmente noti come acidi minerali, caratterizzati dall'essere particolarmente forti rispetto a quelli organici..
Gli acidi e le basi sono intesi come sostanze che hanno rispettivamente un sapore acido o saponaceo. Entrambi sono corrosivi, sebbene la parola "caustica" sia spesso usata per le basi forti. Conclusione: bruciano e corrodono la pelle se vengono toccati. Le sue caratteristiche nel dissolvere i media hanno guidato una serie di definizioni nel corso della storia..
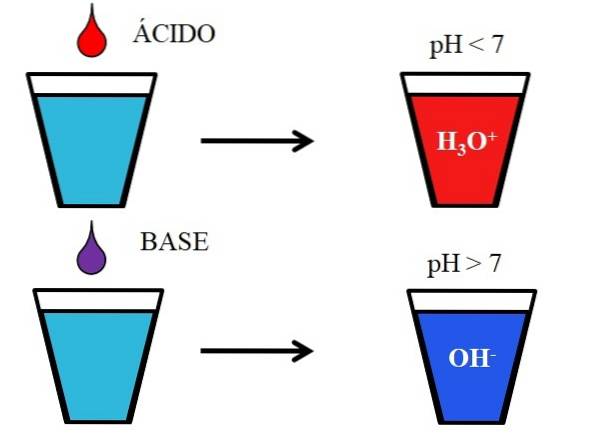
L'immagine sotto mostra il comportamento generico di acidi e basi quando vengono aggiunti o disciolti in un bicchiere d'acqua. Gli acidi producono soluzioni con valori di pH inferiori a 7 a causa degli ioni idronio, H.3O+; mentre le basi producono soluzioni con un pH superiore a 7 a causa degli ioni idrossile (o idrossile), OH-.
Se aggiungiamo acido cloridrico, HCl (goccia rossa), al vetro, ci saranno ioni H.3O+ e Cl- idratato. Se invece ripetiamo l'esperimento con idrossido di sodio, NaOH (goccia viola), avremo ioni OH- e Na+.
Indice articolo
- 1 Definizioni
- 1.1 Arrhenius
- 1.2 Bronsted-Lowry
- 1.3 Lewis
- 2 Esempi di acidi
- 3 Esempi di basi
- 4 Riferimenti
Definizioni

Le caratteristiche sempre più studiate e comprese di acidi e basi hanno stabilito più di una definizione per questi composti chimici. Tra queste definizioni abbiamo quella di Arrhenius, quella di Bronsted-Lowry e infine quella di Lewis. Prima di citare gli esempi è necessario essere chiari su questo.
Arrhenius
Gli acidi e le basi, secondo Arrhenius, sono quelli che, disciolti in acqua, producono ioni H.3O+ o OH-, rispettivamente. Cioè, l'immagine rappresenta già questa definizione. Tuttavia, di per sé trascura alcuni acidi o basi troppo deboli per produrre tali ioni. È qui che entra in gioco la definizione di Bronsted-Lowry..
Bronsted-Lowry
Gli acidi di Bronsted-Lowry sono quelli che possono donare ioni H.+, e le basi sono quelle che accettano questi H+. Se un acido dona molto facilmente la sua H.+, significa che è un acido forte. Lo stesso accade con le basi, ma accettando H.+.
Quindi, abbiamo acidi e basi forti o deboli e le loro forze sono misurate in diversi solventi; soprattutto in acqua, da cui si stabiliscono le unità di pH note (da 0 a 14).
Pertanto, un HA acido forte donerà completamente il tuo H.+ all'acqua in una reazione del tipo:
HA + HDueO => A- + H3O+
Dove- è la base coniugata di HA. Da qui nasce l'H3O+ presente nel bicchiere con soluzione acida.
Nel frattempo, una base debole B deprotonerà l'acqua per guadagnare la sua rispettiva H+:
B + HDueO <=> HB + OH-
Dove HB è l'acido coniugato di B. Questo è il caso dell'ammoniaca, NH3:
NH3 + HDueO <=> NH4+ + Oh-
Una base molto forte può donare direttamente ioni OH- senza la necessità di reagire con l'acqua; proprio come NaOH.
Lewis
Infine, gli acidi di Lewis sono quelli che guadagnano o accettano elettroni e le basi di Lewis sono quelle che donano o perdono elettroni..
Ad esempio, la base NH Bronsted-Lowry3 È anche una base di Lewis, poiché l'atomo di azoto accetta una H.+ donando la sua coppia di elettroni liberi (H.3N: H+). Ecco perché le tre definizioni non sono in disaccordo tra loro, ma piuttosto si intrecciano e aiutano a studiare l'acidità e la basicità in uno spettro più ampio di composti chimici..
Esempi di acidi
Chiarite le definizioni, di seguito verranno menzionate una serie di acidi con le rispettive formule e nomi:
-HF: acido fluoridrico
-HBr: acido bromidrico
-HI: acido idroiodico
-HDueS: idrogeno solforato
-HDueSe: acido selenidrico
-HDueTè: acido telluridrico
Questi sono gli acidi binari, detti anche idracidi, ai quali appartiene il già citato acido cloridrico, HCl.
-HNO3: l'acido nitrico
-HNODue: acido nitroso
-HNO: acido iponitroso
-HDueCO3: acido carbonico
-HDueCODue: acido carbonioso, che in realtà è meglio conosciuto con il nome di acido formico, HCOOH, l'acido organico più semplice di tutti
-H3PO4: acido fosforico
-H3PO3 o HDue[HPO3]: acido fosforoso, con un legame H-P
-H3PODue o H [HDuePODue]: acido ipofosforoso, con due legami H-P
-HDueSW4: acido solforico
-HDueSW3: acido solforoso
-HDueSDueO7: acido disolforico
-HIO4: acido periodico
-HIO3: acido iodico
-HIODue: acido iodico
-HIO: acido ipoiodico
-HDueCrO4: acido cromico
-HMnO4: acido manganico
-CH3COOH: acido acetico (aceto)
-CH3SW3H: acido metansolfonico
Tutti questi acidi, tranne il formico e gli ultimi due, sono noti come ossacidi o acidi ternari..
Altri:
-AlCl3: cloruro di alluminio
-FeCl3: cloruro ferrico
-BF3: trifluoruro di boro
-Cationi metallici disciolti in acqua
-Carbocations
-H (CHBundiciClundici): carborano superacido
- UST3H: acido fluorosolfonico
- HSbF6: acido fluoroantimonico
- UST3H SbF5: acido magico
Gli ultimi quattro esempi costituiscono i temibili superacidi; composti in grado di disintegrare quasi ogni materiale semplicemente toccandolo. AlCl3 è un esempio di acido di Lewis, poiché il centro metallico dell'alluminio è in grado di accettare elettroni a causa della sua carenza elettronica (non completa il suo ottetto di valenza).
Esempi di basi
Tra le basi inorganiche abbiamo idrossidi metallici, come l'idrossido di sodio, e alcuni idruri molecolari, come l'ammoniaca già citata. Ecco altri esempi di basi:
-KOH: idrossido di potassio
-LiOH: idrossido di litio
-RbOH: idrossido di rubidio
-CsOH: idrossido di cesio
-FrOH: idrossido di francio
-Essere (oh)Due: berillio idrossido
-Mg (OH)Due: idrossido di magnesio
-Ca (OH)Due: idrossido di calcio
-Sr (OH)Due: idrossido di stronzio
-Ba (OH)Due: idrossido di bario
-Ra (OH)Due: idrossido di radio
-Fe (OH)Due: idrossido ferroso
-Fe (OH)3: idrossido ferrico
-Al (OH)3: idrossido di alluminio
-Pb (OH)4: idrossido di piombo
-Zn (OH)Due: idrossido di zinco
-Cd (OH)Due: idrossido di cadmio
-Cu (OH)Due: idrossido rameico
-Ti (OH)4: idrossido titanico
-PH3: fosfina
-Cenere3: arsine
-NaNHDue: sodio ammide
- C5H5N: piridina
-(CH3) N: trimetilammina
- C6H5NHDue: fenilammina o anilina
-NaH: idruro di sodio
-KH: idruro di potassio
-Carbanioni
-Li3N: nitruro di litio
-Alcossidi
-[(CH3)DueCH]DueNLi: litio diisopropilammide
-Anione dietinilbenzene: C6H4C4Due- (la base più forte conosciuta finora)
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Naomi Hennah. (10 ottobre 2018). Come insegnare acidi, basi e sali. Estratto da: edu.rsc.org
- Helmenstine, Anne Marie, Ph.D. (31 agosto 2019). Formule di acidi e basi comuni. Estratto da: thoughtco.com
- David Wood. (2019). Confronto tra acidi e basi comuni. Studia. Estratto da: study.com
- Ross Pomeroy. (23 agosto 2013). Gli acidi più forti del mondo: come il fuoco e il ghiaccio. Estratto da: realclearscience.com
- Wikipedia. (2019). Dietinilbenzene dianion. Estratto da: en.wikipedia.org


Nessun utente ha ancora commentato questo articolo.