
Struttura, proprietà, rischi e usi dell'ossido di etilene
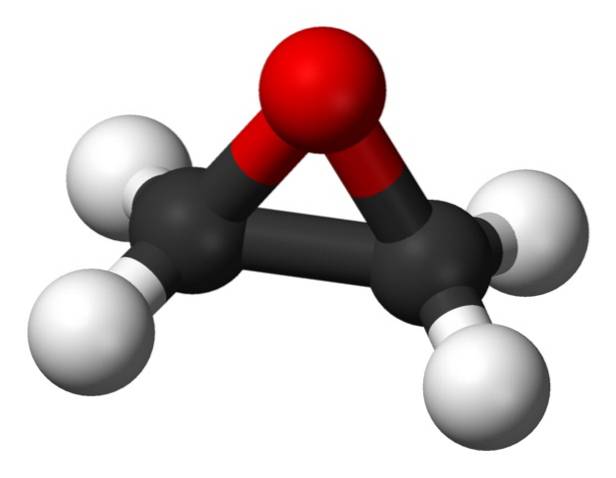
Il ossido di etilene È un composto organico della famiglia degli epossido. A temperatura ambiente è gassoso, incolore e, sebbene sia quasi inodore, ha un odore dolce e lieve, simile a quello degli eteri..
È un componente chimico molto versatile, poiché viene utilizzato in un'ampia varietà di applicazioni industriali per la produzione di altri composti chimici con molteplici usi. Ciò è dovuto alla sua elevata reattività, cioè alla sua facilità di reazione con altre sostanze..
Una delle sue principali applicazioni è come materia prima nella produzione di componenti antigelo per radiatori di veicoli. I suoi derivati sono utilizzati come ingredienti in detergenti industriali o domestici, prodotti cosmetici e shampoo, plastificanti, preparati farmaceutici o unguenti..
È un disinfettante ampiamente utilizzato, ad esempio, nella sterilizzazione di apparecchiature mediche e odontoiatriche, poiché è in grado di distruggere virus, batteri, funghi e spore, soprattutto in condizioni di asciutto. Inoltre, è stato utilizzato per fumigare prodotti alimentari per il confezionamento, sebbene questo uso sia messo in dubbio.
Nonostante la sua utilità, deve essere maneggiato con estrema cautela, poiché può causare irritazioni agli occhi e alla pelle. L'inalazione di ossido di etilene per lunghi periodi può influire sul sistema nervoso. Pertanto, le persone che sono esposte ai suoi vapori o soluzioni dovrebbero utilizzare dispositivi e indumenti protettivi..
Indice articolo
- 1 Struttura
- 2 Proprietà
- 2.1 Altri nomi
- 2.2 Stato fisico
- 2.3 Peso molecolare
- 2.4 Punto di infiammabilità
- 2.5 Densità
- 2.6 Solubilità
- 2.7 Temperatura di autoaccensione
- 2.8 Altre proprietà
- 3 Produzione
- 4 Rischi
- 4.1 Per la salute
- 4.2 Fuoco
- 5 Usi
- 5.1 Applicazioni industriali
- 5.2 Applicazioni mediche
- 5.3 Biblioteche e musei
- 5.4 Agricoltura e alimentazione
- 6 Riferimenti
Struttura
La sua formula molecolare è CDueH4O. Appartiene al gruppo degli epossidi, essendo il più semplice e il più importante di questi. Ha la forma di un anello a tre membri.
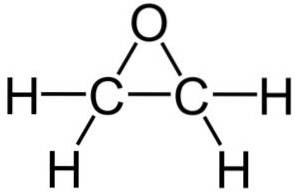
A causa della sua struttura ad anello triangolare, l'ossido di etilene è molto reattivo, il che è dovuto alla facilità con cui l'anello si apre. In media, gli angoli di legame sono di 60 °, il che rende i tuoi legami deboli. La molecola è meno stabile di quella di un etere lineare e tende a reagire facilmente con altri composti chimici..
Proprietà
Altri nomi
- Oxirano.
- Epossietano.
Stato fisico
A temperatura ambiente e sotto pressione atmosferica, è un gas. Al di sotto di 10,6 ºC e alla pressione atmosferica, è un liquido. Al di sotto di -111 ºC è un solido.
Peso molecolare
44,05 g / mol.
Punto d'infiammabilità
Meno di 0ºF (-17,8ºC).
Densità
La sua densità è inferiore a quella dell'acqua, essendo 0,882 a 10 ºC. A loro volta, i suoi vapori sono più pesanti dell'aria.
Solubilità
È solubile in acqua, benzene, acetone, etanolo ed etere. È miscibile con tetracloruro di carbonio.
Temperatura di autoaccensione
428,9 ºC.
Altre proprietà
- Se sottoposto a riscaldamento o contaminazione, può polimerizzare esotermicamente (producendo grandi quantità di calore). Se la polimerizzazione avviene all'interno di un contenitore, può rompersi violentemente.
- Può reagire con materiali ossidanti.
- È estremamente tossico, cancerogeno e un buon generatore di mutazioni nei batteri e nelle cellule dei mammiferi..
Produzione
Su scala industriale viene preparato ossidando l'etilene con l'ossigeno (ODue) dall'aria. La velocità di questa reazione aumenta con la presenza del metallo argento (Ag) e l'azione della temperatura. La reazione è mostrata di seguito:
Ag, 250ºC
2 CDueH4 + ODue -> 2CDueH4O
Etilene Etilene ossido
Rischi
Alla salute
- È stato segnalato che causa disturbi neurologici e può causare la morte. La concentrazione più bassa che può generare effetti tossici per inalazione è 12.500 ppm / 10 secondi (ppm significa: parti per milione).
- È un forte irritante per la pelle, gli occhi e le vie respiratorie..
- L'esposizione a vapori di ossido di etilene ad alta concentrazione può causare irritazione agli occhi, infiammazione della membrana oculare e danni alla cornea..
- Lo sviluppo della cataratta è stato associato all'esposizione ai suoi vapori e schizzi. Le soluzioni concentrate causano gravi danni agli occhi.
- Il contatto di soluzioni acquose di ossido di etilene con la pelle provoca irritazione e può portare a gravi dermatiti con vesciche e ustioni..
- L'inalazione può influenzare il sistema nervoso, provocando mal di testa e nausea, tra gli altri sintomi..
Fuoco
- Se esposto a una fiamma o al calore esiste il pericolo di esplosione. Quando riscaldato, si generano fumi pericolosi.
- Il vapore forma miscele esplosive con l'aria in un'ampia gamma di concentrazioni.
- Evitare di maneggiarlo con apparecchiature che contengono metalli come rame, argento, mercurio, magnesio, alluminio o ossidi di ferro, oltre a evitare agenti come ammoniaca, agenti ossidanti, acidi organici o basi, tra gli altri. Tutti questi materiali possono accelerare la loro polimerizzazione e / o esplosione.
Applicazioni
Applicazioni industriali
Viene utilizzato come intermediario nella produzione di altri prodotti chimici, che a loro volta vengono utilizzati nella produzione di fibre di poliestere per abbigliamento, tappezzeria, tappeti e cuscini..
L'ossido di etilene produce il glicole etilenico utilizzato nell'antigelo per i motori dei veicoli. Il glicole etilenico viene anche utilizzato nella produzione di pellicole per imballaggi in fibra di vetro e plastica..
Altre sostanze chimiche prodotte dall'ossido di etilene includono tensioattivi non ionici utilizzati nei detergenti e nelle formule per il lavaggio dei piatti..
Applicazioni mediche
Viene utilizzato come agente sterilizzante per apparecchiature mediche, come strumenti chirurgici, aghi e iniettori ipodermici o protesi.
Viene anche utilizzato per sterilizzare macchine per emodialisi, apparecchiature di laboratorio, strumenti odontoiatrici, strumenti veterinari, termometri, indumenti chirurgici o attrezzature di pronto soccorso, tra gli altri..

Sebbene siano disponibili diversi metodi per la sterilizzazione delle apparecchiature mediche, in alcuni usi nessun trattamento disponibile può sostituire l'ossido di etilene..
È il caso della sterilizzazione di alcuni materiali sensibili al calore e alle radiazioni, nonché di alcuni strumenti e dispositivi che richiedono la sterilizzazione nel sito di utilizzo negli ospedali..
Biblioteche e musei
In questi luoghi, l'ossido di etilene viene utilizzato per controllare i parassiti come funghi e insetti. Tuttavia, questo uso non è così comune e viene utilizzato quando altre alternative non sono efficaci..
Agricoltura e alimentazione
È stato usato come pesticida, fungicida, fumigante, erbicida, insetticida, rodenticida, tra le altre varianti. Riduce significativamente la popolazione di batteri e funghi nelle spezie.
Tuttavia, per motivi di sicurezza e ambientali, l'uso dell'ossido di etilene per la fumigazione degli alimenti è stato vietato nell'Unione europea e negli Stati Uniti..
Riferimenti
- NOI. Biblioteca nazionale di medicina. (2019). Ossido di etilene. Recupero da pubchem.ncbi.nlm.nih.gov
- Fatti sulla sicurezza chimica. (2019). Ossido di etilene. Estratto da chemicalsafetyfacts.org
- Morrison, Robert Thornton; e Boyd, Robert Neilson. 1992. Chimica organica. Prentice-Hall.
- Moerman, F. e Mager, K. (2016). Pulizia e disinfezione negli impianti di lavorazione degli alimenti secchi. In Handbook of Hygiene Control in the Food Industry (Second Edition). Recuperato da sciendirect.com.
- Eastmond, David A. e Balakrishnan, Sharada. (2010). Genotossicità dei pesticidi. In Hayes 'Handbook of Pesticide Toxicology (terza edizione). Recupero da sciencedirect.com
- Atungulu, G.G. e Pan, Z. (2012). Decontaminazione microbica di noci e spezie. Nella decontaminazione microbica nell'industria alimentare. Recupero da sciencedirect.com



Nessun utente ha ancora commentato questo articolo.