
Struttura, proprietà, usi, rischi dell'ossido di zinco (ZnO)

Il ossido di zinco È un composto inorganico la cui formula chimica è ZnO. È costituito esclusivamente da ioni ZnDue+ meDue- in un rapporto 1: 1; tuttavia, il suo reticolo cristallino può presentare una vacanza di ODue-, che dà origine a difetti strutturali in grado di alterare i colori dei tuoi cristalli sintetici.
Viene acquistato commercialmente come solido bianco polveroso (immagine inferiore), che viene prodotto direttamente dall'ossidazione dello zinco metallico mediante il processo francese; o sottoporre i minerali di zinco a riduzione carbotermica, in modo tale che i loro vapori vengano poi ossidati e finiscano per solidificarsi.

Altri metodi di preparazione di ZnO consistono nel far precipitare il suo idrossido, Zn (OH)Due, da soluzioni acquose di sali di zinco. Allo stesso modo, film sottili o nanoparticelle di ZnO variati dal punto di vista morfologico possono essere sintetizzati utilizzando tecniche più sofisticate come la deposizione chimica dei suoi vapori..
Questo ossido metallico si trova in natura come il minerale zincite, i cui cristalli sono solitamente gialli o arancioni a causa delle impurità metalliche. I cristalli di ZnO sono caratterizzati da essere piezoelettrici, termocromici, luminescenti, polari e hanno anche una banda di energia molto ampia nelle loro proprietà di semiconduttore.
Strutturalmente è isomorfo al solfuro di zinco, ZnS, adottando cristalli esagonali e cubici simili a quelli della wurzite e della blenda, rispettivamente. In questi c'è un certo carattere covalente nelle interazioni tra ZnDue+ meDue-, che provoca una distribuzione eterogenea delle cariche nel cristallo di ZnO.
Gli studi sulle proprietà e gli usi di ZnO si estendono ai campi della fisica, dell'elettronica e della biomedicina. I suoi usi più semplici e quotidiani passano inosservati nella composizione di creme per il viso e prodotti per l'igiene personale, nonché nella protezione solare.
Indice articolo
- 1 Struttura
- 1.1 polimorfi
- 1.2 Interazioni
- 1.3 Morfologia delle nanoparticelle
- 2 Proprietà
- 2.1 Aspetto fisico
- 2.2 Massa molare
- 2.3 Punto di fusione
- 2.4 Densità
- 2.5 Solubilità in acqua
- 2.6 Anfoterismo
- 2.7 Capacità termica
- 2.8 Divario energetico diretto
- 3 usi
- 3.1 Medicinale
- 3.2 Antibatterico
- 3.3 Pigmenti e rivestimenti
- 3.4 Bioimmagini
- 3.5 Additivo
- 3.6 scavenger di idrogeno solforato
- 4 Rischi
- 5 Riferimenti
Struttura
Polimorfi
ZnO cristallizza in normali condizioni di pressione e temperatura in una struttura wurzite esagonale. In questa struttura gli ioni ZnDue+ meDue- sono disposti in strati alternati, in modo tale che ognuno finisca circondato da un tetraedro, con ZnO4 o OZn4, rispettivamente.
Inoltre, utilizzando una "sagoma" o supporto cubico, lo ZnO può essere fatto cristallizzare in una struttura cubica di zinco blenda; che, come la wurzite, corrispondono a strutture isomorfe (identiche nello spazio ma con ioni differenti) del solfuro di zinco, ZnS.
Oltre a queste due strutture (wurzite e blenda), ZnO ad alta pressione (circa 10 GPa) cristallizza nella struttura del salgemma, la stessa di NaCl.
Interazioni
Interazioni tra ZnDue+ meDue- presentano un certo carattere di covalenza, quindi c'è parzialmente un legame covalente Zn-O (entrambi gli atomi con ibridazione sp3), ea causa della distorsione dei tetraedri, manifestano un momento di dipolo che si aggiunge alle attrazioni ioniche dei cristalli di ZnO.
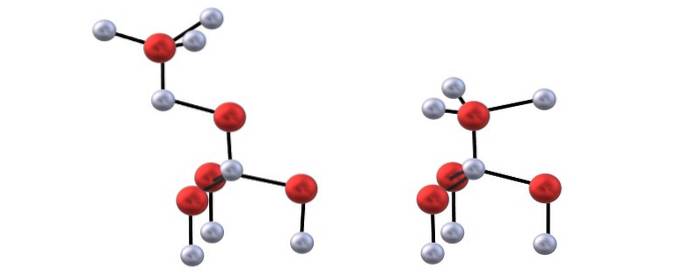
Hai l'immagine in alto per visualizzare i tetraedri menzionati per le strutture ZnO.
La differenza tra le strutture blenda e wurzite sta anche nel fatto che visti dall'alto, gli ioni non vengono eclissati. Ad esempio, nella wurzite, si apprezza che le sfere bianche (ZnDue+) sono appena sopra le sfere rosse (ODue-). D'altra parte, nella struttura cubica della blenda questo non avviene perché ci sono tre strati: A, B e C invece di solo due.
Morfologia delle nanoparticelle
Sebbene i cristalli di ZnO tendano ad avere strutture esagonali di wurzite, la morfologia delle loro nanoparticelle è un'altra storia. A seconda dei parametri e dei metodi di sintesi, questi possono assumere forme diverse come aste, piatti, foglie, sfere, fiori, cinture, aghi, tra gli altri..
Proprietà
Aspetto fisico
Solido bianco, inodore, polveroso con sapore amaro. In natura si può trovare cristallizzato, con impurità metalliche, come il minerale di zincite. Se tali cristalli sono bianchi, presentano termocromismo, il che significa che riscaldati cambiano colore: da bianco a giallo..
Allo stesso modo, i suoi cristalli sintetici possono presentare colori rossastri o verdastri a seconda della loro composizione stechiometrica dell'ossigeno; cioè, le lacune o i posti vacanti causati dalla mancanza di anioni ODue- influenza direttamente il modo in cui la luce interagisce con le reti ioniche.
Massa molare
81,406 g / mol
Punto di fusione
1974 ° C. A questa temperatura subisce decomposizione termica liberando vapori di zinco e ossigeno molecolare o gassoso..
Densità
5,1 g / cm3
Solubilità dell'acqua
ZnO è praticamente insolubile in acqua, difficilmente dando luogo a soluzioni con una concentrazione dello 0,0004% a 18 ºC.
Anfoterismo
ZnO può reagire sia con gli acidi che con le basi. Quando reagisce con un acido in soluzione acquosa, la sua solubilità aumenta formando un sale solubile dove ZnDue+ finisce per complessare con le molecole d'acqua: [Zn (OHDue)6]Due+. Ad esempio, reagisce con l'acido solforico per produrre solfato di zinco:
ZnO + HDueSW4 → ZnSO4 + HDueO
Allo stesso modo, reagisce con gli acidi grassi per formare i loro rispettivi sali, come lo stearato di zinco e il palmitato..
E quando reagisce con una base, in presenza di acqua, si formano i sali di zinco:
ZnO + 2NaOH + HDueO → NaDue[Zn (OH)4]
Capacità termica
40,3 J / K mol
Divario energetico diretto
3.3 eV. Questo valore lo rende un semiconduttore a banda larga, in grado di funzionare sotto intensi campi elettrici. Ha anche le caratteristiche di essere un semiconduttore del tipo n, che non è stato in grado di spiegare le ragioni per cui c'è un contributo extra di elettroni nella sua struttura.
Questo ossido si distingue per le sue proprietà ottiche, acustiche ed elettroniche, grazie alle quali è considerato un candidato per potenziali applicazioni legate allo sviluppo di dispositivi optoelettronici (sensori, diodi laser, celle fotovoltaiche). La ragione di tali proprietà va oltre il regno della fisica.
Applicazioni
Medicinale
L'ossido di zinco è stato utilizzato come additivo in numerose creme bianche per il trattamento di irritazioni, acnes, dermatiti, abrasioni e screpolature della pelle. In quest'area, il suo uso è popolare per alleviare le irritazioni causate dai pannolini sulla pelle dei bambini..
È anche un componente dei filtri solari, perché insieme alle nanoparticelle di biossido di titanio, TiODue, Aiuta a bloccare i raggi ultravioletti del sole. Allo stesso modo, agisce come un agente addensante, motivo per cui si trova in alcuni cosmetici leggeri, lozioni, smalti, talchi e saponi..
D'altra parte, ZnO è una fonte di zinco utilizzata negli integratori alimentari e nei prodotti vitaminici, nonché nei cereali..
Antibatterico
Secondo la morfologia delle sue nanoparticelle, ZnO può essere attivato sotto la radiazione ultravioletta per generare perossidi di idrogeno o specie reattive che indeboliscono le membrane cellulari dei microrganismi.
Quando ciò accade, le rimanenti nanoparticelle di ZnO solcano il citoplasma e iniziano a interagire con il compendio delle biomolecole che compongono la cellula, determinando la loro apoptosi..
Questo è il motivo per cui non tutte le nanoparticelle possono essere utilizzate nelle composizioni per la protezione solare, ma solo quelle prive di attività antibatterica..
I prodotti con questo tipo di ZnO sono progettati, rivestiti con materiali polimerici solubili, per trattare infezioni, ferite, ulcere, batteri e persino diabete..
Pigmenti e rivestimenti
Il pigmento noto come zinco bianco è ZnO, che viene aggiunto a varie vernici e rivestimenti per proteggere le superfici metalliche dove vengono applicati dalla corrosione. Ad esempio, i rivestimenti con ZnO aggiunto vengono utilizzati per proteggere il ferro zincato..
D'altra parte, questi rivestimenti sono stati utilizzati anche sui vetri delle finestre per impedire al calore di penetrare (se è esterno) o entrare (se è interno). Allo stesso modo protegge alcuni materiali polimerici e tessili dal deterioramento dovuto all'azione della radiazione solare e del calore..
Bioimmagini
La luminescenza delle nanoparticelle di ZnO è stata studiata per l'utilizzo in bioimmagini, studiando così le strutture interne delle cellule attraverso le luci blu, verdi o arancioni che irradiano..
Additivo
ZnO trova impiego anche come additivo in gomme, cementi, materiali dentifrici, vetri e ceramiche, grazie al suo punto di fusione più basso e, quindi, comportandosi come fondente..
Eliminatore di idrogeno solforato
ZnO rimuove i gas H sgradevoliDueSì, aiutando a desolforare alcuni fumi:
ZnO + HDueS → ZnS + HDueO
Rischi
L'ossido di zinco in quanto tale è un composto non tossico e innocuo, quindi la manipolazione prudente del suo solido non rappresenta alcun rischio..
Il problema però sta nel suo fumo, perché sebbene ad alte temperature si decomponga, i vapori di zinco finiscono per contaminare i polmoni provocando una sorta di “febbre da metallo”. Questa malattia è caratterizzata da sintomi di tosse, febbre, sensazione di oppressione al petto e un costante sapore metallico in bocca..
Inoltre non è cancerogeno e le creme che lo contengono non hanno dimostrato di aumentare l'assorbimento di zinco nella pelle, quindi i filtri solari a base di ZnO sono considerati sicuri; a meno che non vi siano reazioni allergiche, nel qual caso il suo uso deve essere interrotto.
Per quanto riguarda alcune nanoparticelle progettate per combattere i batteri, queste potrebbero avere effetti negativi se non vengono trasportate correttamente nel loro sito di azione..
Riferimenti
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Ossido di zinco. Estratto da: en.wikipedia.org
- Hadis Morkoç e Ümit Özgur. (2009). Ossido di zinco: fondamenti, materiali e tecnologia dei dispositivi. [PDF]. Recupero da: application.wiley-vch.de
- Parihar, M. Raja e R. Paulose. (2018). Una breve rassegna delle proprietà strutturali, elettriche ed elettrochimiche delle nanoparticelle di ossido di zinco. [PDF]. Estratto da: ipme.ru
- A. Rodnyi e I. V. Khodyuk. (2011). Proprietà ottiche e di luminescenza dell'ossido di zinco. Estratto da: arxiv.org
- Siddiqi, K. S., Ur Rahman, A., Tajuddin e Husen, A. (2018). Proprietà delle nanoparticelle di ossido di zinco e loro attività contro i microbi. Lettere di ricerca su scala nanometrica, 13 (1), 141. doi: 10.1186 / s11671-018-2532-3
- Fatti di sicurezza chimica. (2019). Ossido di zinco. Estratto da: chemicalsafetyfacts.org
- Jinhuan Jiang, Jiang Pi e Jiye Cai. (2018). Il progresso delle nanoparticelle di ossido di zinco per applicazioni biomediche. Chimica e applicazioni bioinorganiche, vol. 2018, ID articolo 1062562, 18 pagine. doi.org/10.1155/2018/1062562



Nessun utente ha ancora commentato questo articolo.