
Volume specifico acqua, aria, vapore, azoto e gas ideale
Il volume specifico è una proprietà intensiva caratteristica di ogni elemento o materiale. Viene definito matematicamente come il rapporto tra il volume occupato da una certa quantità di materia (un chilogrammo o un grammo); in altre parole, è il reciproco della densità.
La densità indica quanto pesa 1 mL di materia (liquida, solida, gassosa o una miscela omogenea o eterogenea), mentre il volume specifico si riferisce al volume che ne occupa 1 g (o 1 kg). Quindi, conoscendo la densità di una sostanza, è sufficiente calcolare il reciproco per determinarne il volume specifico.

A cosa si riferisce la parola "specifico"? Quando si dice che una proprietà è specifica, significa che è espressa in funzione della massa, che ne consente la trasformazione da una proprietà estesa (che dipende dalla massa) a una intensiva (continua in tutti i punti del sistema)..
Le unità in cui viene normalmente espresso il volume specifico sono (m3/ Kg) o (cm3/ g). Tuttavia, sebbene questa proprietà non dipenda dalla massa, dipende da altre variabili, come la temperatura o la pressione incidente sulla sostanza. Questo fa sì che un grammo di sostanza occupi più volume a temperature più elevate..
Indice articolo
- 1 Dall'acqua
- 2 Dall'aria
- 3 Dal vapore
- 4 Azoto
- 5 Del gas ideale
- 6 Riferimenti
Dell'acqua
Nella prima immagine potete vedere una goccia d'acqua che sta per mescolarsi alla superficie del liquido. Poiché è naturalmente una sostanza, la sua massa occupa un volume come qualsiasi altra. Questo volume macroscopico è il prodotto del volume e delle interazioni delle sue molecole.
La molecola d'acqua ha la formula chimica H.DueOppure, con una massa molecolare di circa 18 g / mol. Le densità che presenta dipendono anche dalla temperatura, e su una macroscala la distribuzione delle sue molecole è considerata quanto più omogenea possibile..
Con i valori di densità ρ ad una temperatura T, per calcolare il volume specifico di acqua liquida è sufficiente applicare la seguente formula:
v = (1 / ρ)
Viene calcolato determinando sperimentalmente la densità dell'acqua utilizzando un picnometro e quindi eseguendo il calcolo matematico. Poiché le molecole di ciascuna sostanza sono diverse l'una dall'altra, lo sarà anche il volume specifico risultante.
Se la densità dell'acqua in un ampio intervallo di temperature è 0,997 kg / m3, il suo volume specifico è di 1.003 m3/ kg.
Dall'aria

L'aria è una miscela gassosa omogenea, composta principalmente da azoto (78%), seguito da ossigeno (21%) e infine da altri gas nell'atmosfera terrestre. La sua densità è un'espressione macroscopica di tutta quella miscela di molecole, che non interagiscono in modo efficiente e si propagano in tutte le direzioni..
Poiché si presume che la sostanza sia continua, la sua diffusione in un contenitore non cambia la sua composizione. Anche in questo caso, misurando la densità alle condizioni di temperatura e pressione descritte, è possibile determinare quale volume occupa 1 g di aria.
Poiché il volume specifico è 1 / ρ e il suo ρ è inferiore a quello dell'acqua, il suo volume specifico è maggiore.
La spiegazione di questo fatto si basa sulle interazioni molecolari dell'acqua contro l'aria; quest'ultima, anche in caso di umidità, non condensa se non sottoposta a temperature molto rigide e pressioni elevate.
Dal vapore
Nelle stesse condizioni, un grammo di vapore occuperà un volume maggiore di quello di un grammo d'aria? L'aria è più densa dell'acqua nella fase gassosa, perché è una miscela di gas di cui sopra, a differenza delle molecole d'acqua..
Poiché il volume specifico è l'inverso della densità, un grammo di vapore occupa più volume (è meno denso) di un grammo di aria.
Le proprietà fisiche del vapore come fluido sono essenziali in molti processi industriali: all'interno degli scambiatori di calore, per aumentare l'umidità, pulire i macchinari, tra gli altri..
Ci sono molte variabili da prendere in considerazione quando si manipolano grandi quantità di vapore all'interno delle industrie, soprattutto per quanto riguarda la meccanica dei fluidi..
Azoto
Come il resto dei gas, la sua densità dipende notevolmente dalla pressione (a differenza di solidi e liquidi) e dalla temperatura. Pertanto, i valori per il suo volume specifico variano in base a queste variabili. Da qui la necessità di determinarne il volume specifico per esprimere il sistema in termini di proprietà intensive.
Senza valori sperimentali, attraverso il ragionamento molecolare, è difficile confrontare la densità dell'azoto con quella di altri gas. La molecola di azoto è lineare (N≡N) e quella dell'acqua è angolare.
Poiché una "linea" occupa meno volume di una "Boomerang”, Allora ci si può aspettare che dalla definizione di densità (m / V) l'azoto sia più denso dell'acqua. Utilizzando una densità di 1.2506 Kg / m3, il volume specifico alle condizioni in cui questo valore è stato misurato è di 0,7996 m3/ Kg; è semplicemente il reciproco (1 / ρ).
Del gas ideale
Il gas ideale è quello che obbedisce all'equazione:
P = nRT / V
Si può vedere che l'equazione non considera alcuna variabile come la struttura molecolare o il volume; né considera come le molecole di gas interagiscono tra loro in uno spazio definito dal sistema.
In un intervallo limitato di temperature e pressioni, tutti i gas "si comportano" allo stesso modo; per questo motivo è in qualche misura valido presumere che obbediscano all'equazione dei gas ideali. Pertanto, da questa equazione, è possibile determinare varie proprietà dei gas, incluso il volume specifico.
Per risolverlo, è necessario esprimere l'equazione in termini di variabili di densità: massa e volume. Le moli sono rappresentate da n, e queste sono il risultato della divisione della massa del gas per la sua massa molecolare (m / M).
Prendendo la massa variabile m nell'equazione, se è divisa per il volume, si può ottenere la densità; da qui è sufficiente azzerare la densità e poi "capovolgere" entrambi i lati dell'equazione. In questo modo, il volume specifico viene finalmente determinato.
L'immagine sotto illustra ciascuno dei passaggi per arrivare all'espressione finale del volume specifico di un gas ideale.
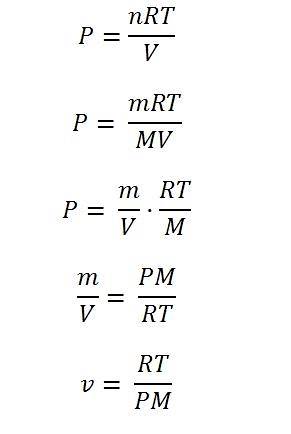
Riferimenti
- Wikipedia. (2018). Volume specifico. Tratto da: en.wikipedia.org
- Study.com. (21 agosto 2017). Cos'è il volume specifico? - Definizione, formula e unità Tratte da: study.com
- POT. (5 maggio 2015). Volume specifico. Tratto da: grc.nasa.gov
- Michael J. Moran e Howard N. Shapiro. (2004). Fondamenti di termodinamica tecnica. (2a edizione). Editorial Reverté, pagina 13.
- Unità 1: Concetti di termodinamica. [PDF]. Tratto da: 4.tecnun.es
- TLV. (2018). Applicazioni principali per Steam. Tratto da: tlv.com


Nessun utente ha ancora commentato questo articolo.