
Trasmittanza cos'è, diagramma dell'energia molecolare e dell'esercizio
Il trasmissione L'ottica è il quoziente tra l'intensità della luce emergente e l'intensità della luce incidente su un campione di soluzione traslucida che è stata illuminata con luce monocromatica..
Viene chiamato il processo fisico del passaggio della luce attraverso un campione trasmissione di luce e il trasmissione è una misura della trasmissione della luce. La trasmittanza è un valore importante per determinare la concentrazione di un campione che è generalmente disciolto in un solvente come acqua o alcol, tra gli altri..
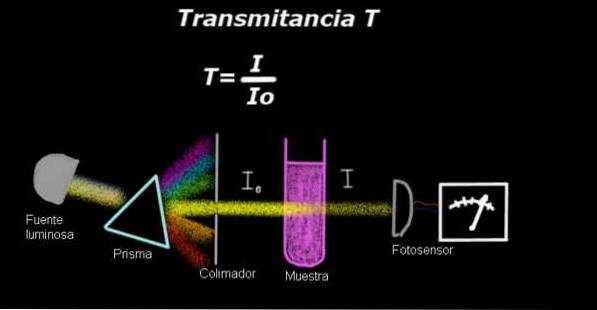
Un elettrofotometro misura una corrente proporzionale all'intensità della luce che cade sulla sua superficie. Per calcolare la trasmittanza, il segnale di intensità corrispondente al solo solvente viene solitamente misurato per primo e questo risultato viene registrato come Io.
Quindi il campione disciolto viene posto nel solvente con le stesse condizioni di illuminazione e il segnale misurato dall'elettro-fotometro è indicato come io, quindi si calcola la trasmittanza secondo la seguente formula:
T = I / Io
Va notato che la trasmittanza è una quantità adimensionale, poiché è una misura dell'intensità luminosa di un campione in relazione all'intensità della trasmissione del solvente..
Indice articolo
- 1 Cos'è la trasmittanza?
- 1.1 Assorbimento della luce in un mezzo
- 1.2 Teoria molecolare dell'assorbimento della luce
- 2 Diagramma dell'energia molecolare
- 2.1 Fattori da cui dipende la trasmittanza
- 3 Esercizio risolto
- 3.1 Esercizio 1
- 4 Riferimenti
Cos'è la trasmittanza?
Assorbimento della luce in un mezzo
Quando la luce passa attraverso un campione, parte dell'energia luminosa viene assorbita dalle molecole. La trasmittanza è la misura macroscopica di un fenomeno che si verifica a livello molecolare o atomico.
La luce è un'onda elettromagnetica, l'energia che trasporta è nel campo elettrico e magnetico dell'onda. Questi campi oscillanti interagiscono con le molecole di una sostanza.
L'energia trasportata dall'onda dipende dalla sua frequenza. La luce monocromatica ha una singola frequenza, mentre la luce bianca ha una gamma o uno spettro di frequenze..
Tutte le frequenze di un'onda elettromagnetica viaggiano nel vuoto alla stessa velocità di 300.000 km / s. Se indichiamo con c alla velocità della luce nel vuoto, il rapporto di frequenza F e lunghezza d'onda λ è:
c = λ⋅f
Che cosa c è una costante ad ogni frequenza corrisponde alla sua rispettiva lunghezza d'onda.
Per misurare la trasmittanza di una sostanza, vengono utilizzate le regioni dello spettro elettromagnetico visibile (da 380 nm a 780 nm), la regione dell'ultravioletto (da 180 a 380 nm) e la regione dell'infrarosso (da 780 nm a 5600 nm).
La velocità di propagazione della luce in un mezzo materiale dipende dalla frequenza ed è inferiore a c. Questo spiega la diffusione in un prisma con cui è possibile separare le frequenze che compongono la luce bianca..
Teoria molecolare dell'assorbimento della luce
Gli atomi e le molecole hanno livelli di energia quantizzati. A temperatura ambiente le molecole sono ai livelli energetici più bassi.
Il fotone è la particella quantistica associata all'onda elettromagnetica. Anche l'energia del fotone è quantizzata, cioè un fotone di frequenza F ha energia data da:
E = h⋅f
dove h è la costante di Planck il cui valore è 6,62 × 10 ^ -34 J⋅s.
La luce monocromatica è un fascio di fotoni di una data frequenza ed energia.
Le molecole assorbono i fotoni quando la loro energia corrisponde alla differenza necessaria per portare la molecola a un livello di energia superiore.
Le transizioni energetiche per assorbimento dei fotoni nelle molecole possono essere di diversi tipi:
1- Transizioni elettroniche, quando gli elettroni degli orbitali molecolari vanno verso orbitali di maggiore energia. Queste transizioni si verificano generalmente nelle gamme del visibile e dell'ultravioletto e sono le più importanti.
2- Transizioni vibrazionali, anche le energie dei legami molecolari vengono quantizzate e quando un fotone dalla regione dell'infrarosso viene assorbito, la molecola va in uno stato di energia vibrazionale superiore.
3- Transizioni rotazionali, quando l'assorbimento di un fotone porta la molecola in uno stato rotazionale di maggiore energia.
Diagramma di energia molecolare
Queste transizioni sono meglio comprese con un diagramma dell'energia molecolare mostrato nella Figura 2:
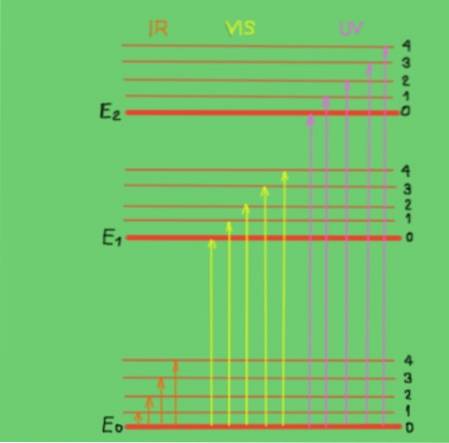
Nel diagramma le linee orizzontali rappresentano diversi livelli di energia molecolare. La linea E0 è il livello di energia fondamentale o inferiore. I livelli E1 ed E2 sono livelli eccitati di energia superiore. I livelli E0, E1, E2 corrispondono agli stati elettronici della molecola.
I sottolivelli 1, 2, 3, 4 all'interno di ciascun livello elettronico corrispondono ai diversi stati vibrazionali corrispondenti a ciascun livello elettronico. Ciascuno di questi livelli ha suddivisioni più fini che non vengono mostrate corrispondere agli stati rotazionali associati a ciascun livello vibrazionale..
Il diagramma mostra le frecce verticali che rappresentano l'energia dei fotoni nelle gamme dell'infrarosso, del visibile e dell'ultravioletto. Come si può vedere, i fotoni infrarossi non hanno abbastanza energia per promuovere le transizioni elettroniche, mentre la radiazione visibile e quella ultravioletta sì..
Quando i fotoni incidenti di un fascio monocromatico coincidono in energia (o frequenza) con la differenza di energia tra gli stati di energia molecolare, si verifica l'assorbimento dei fotoni..
Fattori da cui dipende la trasmittanza
Secondo quanto detto nella sezione precedente, la trasmittanza dipenderà poi da diversi fattori, tra i quali possiamo citare:
1- La frequenza con cui il campione viene illuminato.
2- Il tipo di molecole da analizzare.
3- La concentrazione della soluzione.
4- La lunghezza del percorso percorso dal raggio di luce.
I dati sperimentali indicano che la trasmittanza T diminuisce in modo esponenziale con la concentrazione C e con la lunghezza L del cammino ottico:
T = 10-a⋅C⋅L
Nell'espressione sopra per è una costante che dipende dalla frequenza e dal tipo di sostanza.
Esercizio risolto
Esercizio 1
Un campione standard di una determinata sostanza ha una concentrazione di 150 micromoli per litro (μM). Quando la sua trasmittanza viene misurata con una luce di 525 nm, si ottiene una trasmittanza di 0,4..
Un altro campione della stessa sostanza, ma di concentrazione sconosciuta, ha una trasmittanza di 0,5, se misurato alla stessa frequenza e con lo stesso spessore ottico..
Calcola la concentrazione del secondo campione.
Risposta
La trasmittanza T decade esponenzialmente con la concentrazione C:
T = 10-b⋅L
Se viene preso il logaritmo dell'uguaglianza precedente, rimane:
log T = -b⋅C
Dividendo membro per membro la precedente uguaglianza applicata a ciascun campione e risolvendo per la concentrazione sconosciuta rimane:
C2 = C1⋅ (log T2 / log T1)
C2 = 150μM⋅ (log 0,5 / log 0,4) = 150μM⋅ (-0,3010 / -0,3979) = 113,5μM
Riferimenti
- Atkins, P. 1999. Chimica fisica. Edizioni Omega. 460-462.
- La guida. Trasmittanza e assorbanza. Estratto da: quimica.laguia2000.com
- Tossicologia ambientale. Trasmittanza, assorbanza e legge di Lambert. Estratto da: repositorio.innovacionumh.es
- Avventura fisica. Assorbanza e trasmittanza. Estratto da: rpfisica.blogspot.com
- Spettrofotometria. Recupero da: chem.libretexts.org
- Tossicologia ambientale. Trasmittanza, assorbanza e legge di Lambert. Estratto da: repositorio.innovacionumh.es
- Wikipedia. Trasmissione. Estratto da: wikipedia.com
- Wikipedia. Spettrofotometria. Estratto da: wikipedia.com



Nessun utente ha ancora commentato questo articolo.