
May Grünwald-Giemsa macchia razionale, tecnica e usi

Il Può macchiare Grünwald-Giemsa o Pappenheim è una tecnica di colorazione differenziale che miscela i reagenti Giemsa e May Grünwald. Viene utilizzato per la differenziazione di cellule del sangue normali e anormali in strisci di sangue periferico e midollo osseo, nonché per la colorazione di sezioni istologiche e campioni citologici..
Entrambi i reagenti -Giemsa e May Grünwald- derivano dalla colorazione di tipo Romanowsky, una tecnica basata sulla combinazione di coloranti acidi e basici..
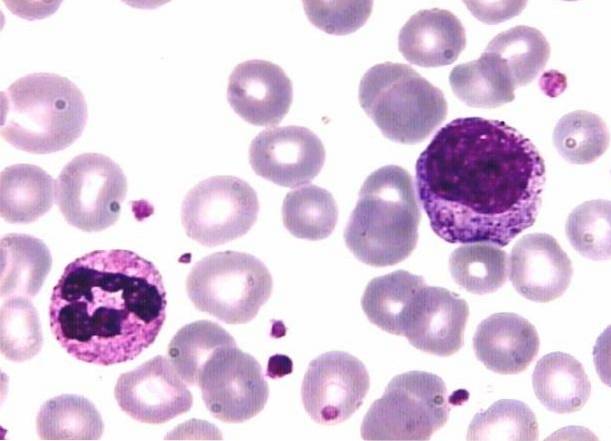
Giemsa ha migliorato la tecnica stabilizzando la miscela di eosina, blu di metilene e loro derivati, con glicerolo. May Grünwald utilizza invece eosina e blu di metilene, utilizzando metanolo come solvente. Questa combinazione strategica ha dato ottimi risultati.
Sebbene in termini di osservazione della morfologia cellulare agisca in modo simile alle colorazioni di Giemsa e Wright, questa tecnica migliora le precedenti affinando la colorazione dei parassiti che causano malaria, malattia di Chagas, leishmaniosi e tricomoniasi..
Inoltre, si è dimostrata una tecnica molto utile per lo studio citologico del liquido spermatico. Si è distinto non solo mostrando le caratteristiche morfologiche degli spermatozoi, ma anche consentendo la differenziazione di leucociti, cellule epiteliali e cellule di spermatogenesi con grande efficienza..
Indice articolo
- 1 Razionale
- 1.1 Varietà di coloranti
- 2 Tecnica
- 2.1 Materiali
- 2.2 Soluzione colorante concentrata di May Grünwald
- 2.3 Colorante Giemsa concentrato
- 2.4 Preparazione della soluzione tampone a pH 7.2
- 2.5 Procedura di colorazione dello striscio di sangue o midollo osseo
- 2.6 Tecnica per colorare strisci di liquido spermatico
- 2.7 Specifiche importanti
- 3 usi
- 3.1 Citologia vaginale
- 3.2 Campione di sperma
- 4 Riferimenti
Base
La tecnica segue le fondamenta dei coloranti Romanowsky, in cui i coloranti acidi hanno affinità selettiva per i componenti cellulari di base e i componenti acidi attraggono le macchie di base..
Spiegato in altro modo, sia le strutture cellulari che i coloranti hanno cariche elettriche positive o negative; cariche simili si respingono e cariche diverse si attraggono.
Ad esempio, i coloranti di base come il blu di metilene sono caricati positivamente e attratti da strutture caricate negativamente. Questo è il motivo per cui questo colorante colora i nuclei ricchi di DNA e RNA che hanno gruppi fosfato caricati negativamente..
Anche i granuli dei basofili segmentati e i citoplasmi dei globuli bianchi mononucleari contenenti RNA sono colorati..
Allo stesso modo, il colorante acido porta una carica negativa, motivo per cui si lega a strutture caricate positivamente come eritrociti e granuli di eosinofili segmentati. Per quanto riguarda i granuli dei neutrofili segmentati, questi fissano entrambi i coloranti.
Varietà di coloranti
In questa tecnica, una combinazione di reazioni coesiste tra coloranti ortocromatici e metacromatici. Gli ortocromatici (eosina e blu di metilene) si legano alla struttura cellulare a cui sono correlati e forniscono un colore stabile che non varia.
D'altra parte, i metacromatici (i derivati del blu di metilene azzurro A e azzurro B), variano il loro colore originale una volta attaccati alla struttura specifica e possono esserci anche una varietà di sfumature.
Infine, il passaggio che la soluzione di May Grünwald compie richiede la presenza di acqua, poiché senza di essa il colorante penetrerà nelle strutture ma non si fisserà. Perché ciò avvenga, il colorante deve diventare polare o ionizzare, e quindi essere in grado di precipitare e legarsi alle strutture correlate..
Tecnica
Materiali
- Vetrini per microscopio.
- Ponti di colorazione.
- Soluzione May-Grünwald.
- Macchia di Giemsa.
- Acqua distillata.
Può Grünwald colorante soluzione concentrata
Pesare 0,25 g di blu eosina-metilene (colorazione secondo May Grünwald) e scioglierli in 100 ml di metanolo. Quindi la preparazione viene mescolata per 1 ora e lasciata riposare per 24 ore. Quando il tempo è scaduto, perde.
Per applicare la tecnica, il colorante May Grünwald deve essere diluito come segue: per 200 ml di colorante diluito, misurare 30 ml della soluzione concentrata, aggiungere 20 ml di soluzione tampone e 150 ml di acqua distillata aggiustata a pH 7.2-7.3. Successivamente viene miscelato e filtrato.
Concentrato di colorante Giemsa
Pesare 0,5 g di azzurro-eosina-blu di metilene (colorazione secondo Giemsa), sciolti in 50 ml di metanolo e 50 ml di glicerina aggiunti alla miscela.
Per eseguire la tecnica, viene diluito 1:10 con soluzione tampone e lasciato riposare per 10 minuti. Può essere filtrato se necessario.
Preparazione della soluzione tampone a pH 7,2
Dovrebbero essere pesati:
- 40 mg di potassio fosfato monobasico (KH2PO4).
- 151 mg di sodio idrogenofosfato 12-idrato (Na2HPO4).
Entrambi i composti vengono sciolti in 100 ml di acqua.
Procedura di colorazione dello striscio di sangue o midollo osseo
Ci sono due modalità: una classica e una veloce.
Modalità classica
- Coprire gli strisci per 2-3 minuti con la soluzione diluita di May-Grünwald..
- Lavare con acqua distillata tamponata per rimuovere la soluzione precedente.
- Coprire con la stessa soluzione di lavaggio tamponata e lasciare agire per 1 minuto. L'idea è che il colorante precedente sia fissato alle strutture e che, allo stesso tempo, le cellule siano idratate.
- Aggiungere 12 gocce di tintura Giemsa diluita all'acqua tamponata e soffiare per mescolare e omogeneizzare. Lasciar riposare per 15-20 minuti.
- Lavare gli strisci con acqua distillata tamponata e lasciarli asciugare all'aria.
- Mettere a fuoco e osservare le cellule del sangue colorate al microscopio ottico utilizzando l'obiettivo 40X. Se necessario, è possibile utilizzare il 100X.
Modalità rapida
- Coprire lo striscio con il colorante May Grünwald diluito per 1 minuto..
- Lavare con acqua distillata tamponata.
- Coprite con acqua tamponata e lasciate riposare per 1 minuto.
- Posizionare la macchia di Giemsa diluita e lasciare agire per 5 minuti.
- Lavare con acqua distillata tamponata e lasciare asciugare all'aria.
Le tecniche qui descritte sono una linea guida, ma va tenuto presente che le procedure ei tempi di colorazione variano a seconda dell'azienda commerciale che distribuisce i reagenti. Si consiglia di seguire i passaggi strettamente indicati da ogni casa commerciale.
Tecnica per colorare strisci di liquido spermatico
1- Coprire lo striscio con uno strato sottile della soluzione di May Grünwald per 4 minuti.
2- Rimuovere il colorante e lavare con acqua distillata.
3- Porre uno strato di Giemsa diluito (1:10) in acqua distillata per 15 minuti.
4- Rimuovere il colorante e lavare con acqua distillata.
5- Lasciar asciugare e osservare al microscopio.
Specifiche importanti
La tecnica richiede che i reagenti e le soluzioni di lavaggio abbiano un pH regolato a 7,2 -7,3, in modo che le affinità dei coloranti per le strutture cellulari non vengano distorte e il colore finale previsto non vari..
Applicazioni
Questa tecnica viene utilizzata dai laboratori clinici per colorare strisci di sangue periferico e midollo osseo, sezioni di tessuto e citologie..
In campo ematologico, questa tecnica è di vitale importanza nello studio delle anomalie delle cellule in termini di forma, dimensione e numero. È uno strumento molto prezioso per la diagnosi di alcune malattie, come leucemie e anemie.
Inoltre, è di eccezionale utilità nella ricerca di parassiti nelle aree ematologiche (Plasmodium sp Y Trypanosome cruzi) o istologico (Leishmania sp).
Citologia vaginale
Per quanto riguarda la citologia vaginale, questa tecnica è particolarmente vantaggiosa per l'osservazione di Trichomonas vaginalis. Questa è una scoperta importante, poiché la sua presenza simula immagini di carcinoma. sul posto che poi scompaiono quando il parassita viene rimosso.
Campione di sperma
È stato uno strumento ideale per lo studio dei campioni di sperma, poiché fornisce preziose informazioni sulla qualità dello sperma.
I dati che offre hanno a che fare principalmente con il numero e la morfologia, nonché con le cellule concomitanti che possono essere presenti e che sono di vitale importanza, come le cellule germinali, leucociti e le cellule epiteliali..
Con questa analisi è possibile descrivere le anomalie osservate nello sperma nella testa, nel collo, nella parte centrale e nella parte principale..
Inoltre, possono anche aiutare a mostrare casi di emospermia (presenza di globuli rossi nello sperma) e leucospermia o piospermia (aumento del numero di leucociti nello sperma).
Riferimenti
- Costamagna S, Prado M. Validazione del test fresco, colorazioni May Grünwald-Giemsa e Gram e terreni di coltura per la diagnosi di Trichomonas vaginalis. Parasitol. 2001; 25 (1-2): 60-64. Disponibile in: scielo.
- Laboratorio Merck KGaA. May Grünwald eosina blu di metilene per microscopia.
- "Macchia May-Grünwald-Giemsa." Wikipedia, l'enciclopedia libera. 15 novembre 2018, 14:37 UTC. 8 gennaio 2019, 04:29: en.wikipedia.org
- Laboratorio Panreac di Glass Chemicals. Reagenti per tecniche istologiche, ematologiche e microbiologiche. Disponibile su: glasschemicals.com
- Retamales E, Manzo V. Raccomandazione per la colorazione di strisci di sangue per la lettura dell'emogramma. Laboratorio biomedico nazionale e di riferimento. Istituto di sanità pubblica del Cile.
- Sarabia L. Spermiogram secondo i criteri dell'OMS. Programma di anatomia e biologia dello sviluppo. Scuola di Medicina. Università del Cile. Disponibile su: pp.centramerica.com



Nessun utente ha ancora commentato questo articolo.