
Razionale e tecniche di colorazione Kinyoun

Il Macchia di Kinyoun è una tecnica di colorazione utilizzata per colorare batteri e parassiti acido-resistenti. Nasce dalla modifica della colorazione Ziehl-Neelsen; Entrambe le tecniche sono interpretate allo stesso modo ma differiscono per due elementi: nella preparazione del reagente principale e nel fatto che la tecnica Kinyoun non utilizza il calore.
Per questo motivo è anche noto come Ziehl-Neelsen modificato a freddo o macchia fredda Kinyoun. È indicato per la colorazione di Mycobacterium tuberculosis, Mycobacterium leprae, micobatteri atipici, Nocardias sp, Cryptosporidium parvum, Cryptosporidium meleagridis, Cryptosporidium felis, Cryptosporidium muris Y Cyclosporas cayetanensis.
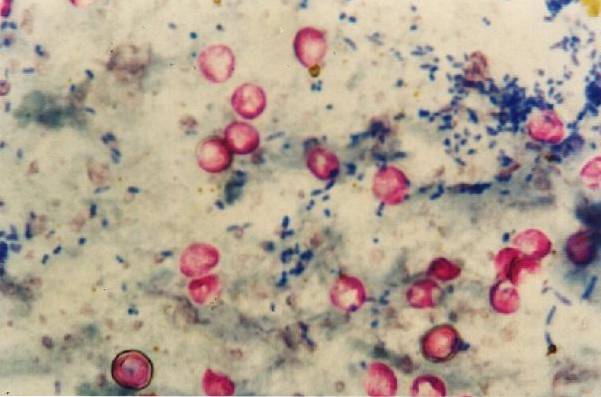
Vale la pena notare che le Nocardia si colorano debolmente con questa tecnica poiché sono parzialmente acido-alcool resistenti, quindi per questo genere c'è una modifica della metodologia.
A sua volta, la tecnica Kinyoun a freddo è stata combinata con la tecnica tricromica modificata da Didier per la rilevazione dei coccidi (Cryptosporidium parvum e Isospora belli) e spore di microsporidi (Enterocytozoon bieneusi Y Encephalitozoon intestinalis).
Indice articolo
- 1 Razionale
- 2 Tecnica
- 2.1 Materiali
- 2.2 Preparazione del carbol fuchsin di Kinyoun
- 2.3 Preparazione dell'acido-alcol
- 2.4 Preparazione del colorante di contrasto blu di metilene
- 2.5 Tecnica di colorazione Kinyoun
- 2.6 Tecnica Kinyoun speciale per Nocardie
- 2.7 Tecnica combinata di carbol fuchsin e tricromia modificata da Didier
- 2.8 Controllo di qualità
- 3 Tecnica Kinyoun a confronto con la tecnica Ziehl-Neelsen
- 4 Riferimento
Base
Il principale reagente di colorazione è la carbolfucsina o carbol fuchsin, che ha la proprietà di legarsi agli acidi carbolici esistenti all'interno della parete cellulare cerosa, ricchi di lipidi (acidi micolici) di micobatteri e di alcuni parassiti..
Questo legame non viene contrastato dalla candeggina acida; pertanto, i microrganismi sono definiti resistenti all'alcool acido.
A differenza della tecnica Ziehl-Neelsen -che fissa il colorante attraverso il calore-, nella tecnica Kinyoun questo passaggio non è necessario, poiché la soluzione di carbol fuchsin preparata per questa tecnica contiene un'alta concentrazione di fenolo..
Il fenolo dissolve il materiale lipidico nella parete cellulare, permettendo al colorante carbolfuchsina di entrare. Dopo che il colorante è penetrato, rimane fisso nonostante il lavaggio con l'alcool acido.
In questo modo i microrganismi resistenti agli acidi assumono il caratteristico colore rosso, mentre tutto ciò che non è alcol resistente agli acidi si scolorisce e si tinge di blu..
Tecnica
Materiali
- Carbol fuchsin modificato.
- Acido alcolico.
- Blu di metilene.
Preparazione di Kinyoun Carbol Fuchsin
- Fucsina base: 4 gr.
- Fenolo: 8 ml.
- Alcol (95%): 20 ml.
- Acqua distillata: 100 ml.
La fucsina di base va sciolta lentamente nell'alcool, mescolando continuamente. Successivamente, il fenolo cristallizzato viene sciolto a bagnomaria a 56 ° C. Una volta sciolto, si aggiungono 8 ml alla soluzione di fucsina preparata sopra.
Preparazione dell'acido alcolico
- Acido cloridrico concentrato: 3 ml.
- Etanolo (95%): 97 ml.
Deve essere misurato, unito e miscelato.
Preparazione del colorante di contrasto blu di metilene
- Blu di metilene: 0,3 g.
- Acqua distillata: 100 ml.
Viene pesato e sciolto.
Tecnica di colorazione Kinyoun
1- Preparare uno striscio direttamente dal campione, che può essere espettorato, liquido polmonare, sedimento urinario, liquido cerebrospinale o feci, tra gli altri; o da una sospensione di microrganismi ottenuta da colonie pure sviluppate in terreni di coltura primari.
2- Fissare lo striscio con il calore.
3- Posizionare lo striscio sul ponte di colorazione e coprire con il reagente Kinyoun carbol fuchsin preparato. Lascia riposare per 3 o 5 minuti.
4- Lavare con acqua distillata.
5- Candeggiare con alcool acido per 3 minuti e risciacquare con acqua distillata.
6- Candeggiare di nuovo con alcool acido per 1 o 2 minuti fino a quando non viene più eliminata la colorazione.
7- Lavare con acqua distillata e lasciare sgocciolare, ponendo il vetrino in posizione verticale.
8- Coprire la preparazione con blu di metilene e lasciare agire 4 minuti.
9- Lavare con acqua distillata e lasciare asciugare all'aria.
10- Esaminare a 40X e poi a 100X.
Se si desidera migliorare e accelerare la colorazione dei microrganismi acido-resistenti, aggiungere 1 goccia di un agente umettante (come il tergitolo n. 7) a 30 o 40 ml di Kinyoun Carbol Fuchsin.
Alcuni laboratori cambiano il colorante di contrasto blu di metilene in verde brillante o acido picrico; il primo dà un colore verde allo sfondo e il secondo genera un colore giallo.
Tecnica Kinyoun speciale per Nocardie
Per migliorare la colorazione dei batteri del genere Nocardia, viene utilizzata una modifica della colorazione Kinyoun. La tecnica è la seguente:
1- Coprire lo striscio con Kinyoun carbol fuchsin per 3 minuti.
2- Lavare con acqua distillata.
3- Scolorire brevemente con alcool acido preparato al 3% fino a quando non viene più effettuata la colorazione.
4- Lavare di nuovo con acqua distillata.
5- Coprire la preparazione con blu di metilene e lasciare agire per 30 secondi.
6- Lavare con acqua distillata e lasciare asciugare all'aria.
Tecnica combinata di carbol fuchsin e tricromia modificata da Didier
Questa tecnica è consigliata per l'analisi di campioni di feci per coccidi e spore di Microsporidium sp allo stesso tempo. La procedura da seguire è la seguente:
1- Coprire lo striscio con Kinyoun carbol fuchsin per 10 minuti.
2- Rimuovere il colorante e lavare con acqua distillata.
3- Candeggina per 30 secondi con alcol acido cloridrico.
4- Lavare di nuovo con acqua distillata.
5- Coprire lo striscio con soluzione tricromica per 30 minuti a 37 ° C.
6- Lavare con acqua distillata.
7- Candeggina per 10 secondi con alcol acido acetico.
8- Lavare lo striscio per 30 secondi utilizzando etanolo al 95%.
QA
Come controllo positivo, gli strisci vengono preparati con ceppi di Mycobacterium tuberculosis e macchiare con i reagenti preparati per verificare che i batteri assumano il colore corretto (rosso-fucsia).
I controlli negativi possono essere utilizzati anche preparando strisci con qualsiasi ceppo che non sia acido-resistente, verificando così che l'intero campione assuma il colore contrastante..
Tecnica Kinyoun rispetto alla tecnica Ziehl-Neelsen
La tecnica Kinyoun è più semplice poiché elimina la fase di riscaldamento, ma il suo principale vantaggio è quello di evitare l'emissione di vapori, altamente tossici e cancerogeni a lungo termine. Pertanto, la macchia Kinyoun è più sicura per il personale addetto alla colorazione..
È importante tenere presente che è necessario prestare attenzione che i reagenti non vengano a contatto diretto con la pelle, poiché sono corrosivi e la candeggina è infiammabile..
Per quanto riguarda gli svantaggi, uno striscio negativo non indica necessariamente che l'organismo non è presente. Inoltre, la presenza di detriti cellulari può portare a falsi positivi, portando a confusione nella diagnosi..
Riferimento
- Chimica clinica applicata. (2016). Kit BK Kinyoun, disponibile su: cromakit.es
- Orozco-Rico Miguel. Macchia di Kinyoun e due coccidi nell'HIV. Medical Journal MD. 2011; 3 (2): 137
- Forbes B, Sahm D, Weissfeld A (2009). Bailey & Scott Microbiological Diagnosis. 12 ed. Argentina. Editoriale Panamericana S.A.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosi microbiologica. (5a ed.). Argentina, Editoriale Panamericana S.A.
- Collaboratori di Wikipedia. "Macchia Kinyoun." Wikipedia, l'enciclopedia libera. Wikipedia, The Free Encyclopedia, 8 febbraio 2018. Web. 5 gennaio 2019.
- Combol A, Fernández N, Figueredo E, Acuña A, Zanetta E. Implementazione di una tecnica di colorazione per la diagnosi simultanea di Coccidia e Microsporidia. Istituto di Igiene dell'Università della Repubblica. Montevideo. Uruguay. Disponibile su: Hygiene.edu.uy



Nessun utente ha ancora commentato questo articolo.