
Struttura, proprietà, usi, rischi dell'anidride solforosa (SO2)

Il diossido di zolfo è un composto inorganico gassoso formato da zolfo (S) e ossigeno (O), la sua formula chimica è SODue. È un gas incolore con un odore irritante e soffocante. Inoltre, è solubile in acqua, formando soluzioni acide. I vulcani lo espellono nell'atmosfera durante le eruzioni.
Fa parte del ciclo biologico e geochimico dello zolfo, ma è prodotto in grandi quantità da alcune attività umane come la raffinazione del petrolio e la combustione di combustibili fossili (carbone o diesel per esempio).

Il SODue è un agente riducente che permette alla pasta di carta di rimanere bianca dopo la sbianca con altri composti. Serve anche a rimuovere le tracce di cloro nell'acqua trattata con questa sostanza chimica.
Viene utilizzato per conservare alcuni tipi di alimenti, per disinfettare contenitori dove si produce la fermentazione del succo d'uva per produrre vino o orzo per fare birra..
Viene anche utilizzato come fungicida in agricoltura, per ottenere acido solforico, come solvente e come intermedio nelle reazioni chimiche..
Il SODue presente nell'atmosfera è dannoso per molte piante, in acqua colpisce i pesci ed è anche uno dei responsabili delle "piogge acide" che corrode i materiali creati dall'uomo.
Indice articolo
- 1 Struttura
- 2 Nomenclatura
- 3 Proprietà
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Punto di fusione
- 3.4 Punto di ebollizione
- 3.5 Densità
- 3.6 Solubilità
- 3,7 pH
- 3.8 Proprietà chimiche
- 3.9 Soluzioni acquose di SO2
- 3.10 Altre proprietà
- 4 Ottenimento
- 5 Presenza in natura
- 6 Usi
- 6.1 Nella produzione di acido solforico
- 6.2 Nell'industria alimentare trasformata
- 6.3 Come solvente e reagente
- 6.4 Come agente riducente
- 6.5 In varie applicazioni
- 7 Effetti della SO2 endogena
- 8 Rischi
- 8.1 Ecotossicità
- 8.2 Effetti dell'ingestione con il cibo
- 9 Riferimenti
Struttura
La molecola di anidride solforosa è simmetrica e forma un angolo. L'angolo è dovuto all'SODue Ha una coppia di elettroni solitari, cioè elettroni che non formano un legame con nessun atomo ma sono liberi.
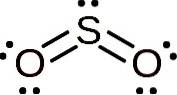
Nomenclatura
- Diossido di zolfo
- Anidride solforosa
- Ossido solforoso.
Proprietà
Stato fisico
Gas incolore.
Peso molecolare
64,07 g / mol
Punto di fusione
-75,5 ºC
Punto di ebollizione
-10,05 ºC
Densità
Gas: 2,26 a 0 ° C (relativo all'aria, ovvero densità dell'aria = 1). Ciò significa che è più pesante dell'aria..
Liquido: da 1,4 a -10 ° C (relativo all'acqua, ovvero densità dell'acqua = 1).
Solubilità
Solubile in acqua: 17,7% a 0 ° C; 11,9% a 15 ° C; 8,5% a 25 ° C; 6,4% a 35 ° C.
Solubile in etanolo, etere dietilico, acetone e cloroformio. È meno solubile in solventi non polari.
pH
Soluzioni acquose di SODue sono acidi.
Proprietà chimiche
Il SODue è un potente agente riducente e ossidante. In presenza di aria e di un catalizzatore si ossida a COSÌ3.
SWDue + ODue → COSÌ3
Le coppie solitarie di elettroni a volte la fanno comportare come una base di Lewis, in altre parole, può reagire con composti dove c'è un atomo a cui mancano elettroni.
Se il sistema operativoDue è sotto forma di gas e secco non attacca le leghe di ferro, acciaio, rame-nichel o nichel-cromo-ferro. Tuttavia, se è allo stato liquido o umido, provoca corrosione a questi metalli..
Il SODue il liquido con lo 0,2% di acqua o più produce una forte corrosione su ferro, ottone e rame. È corrosivo per l'alluminio.
Quando è liquido può attaccare anche alcune plastiche, gomme e rivestimenti.
Soluzioni acquose di SODue
Il SODue è molto solubile in acqua. È stato a lungo considerato che nell'acqua si forma l'acido solforoso HDueSW3, ma l'esistenza di questo acido non è stata provata.
Nelle soluzioni OSDue in acqua si verificano i seguenti equilibri:
SWDue + HDueO ⇔ SODue.HDueO
SWDue.HDueO ⇔ HSO3- + H3O+
HSO3- + HDueO ⇔ SO3Due- + H3O+
Dove HSO3- è lo ione bisolfito e SO3Due- è lo ione solfito. Lo ione solfito SO3Due- si verifica principalmente quando un alcali viene aggiunto alla soluzione SODue.
Soluzioni acquose di SODue possiedono proprietà riducenti, soprattutto se alcaline.
Altre proprietà
- È estremamente stabile al calore, anche fino a 2000 ° C.
- Non è infiammabile.
Ottenere
Il SODue Si ottiene dalla combustione dello zolfo (S) presente nell'aria, sebbene si formino anche piccole quantità di SO3.
S + ODue → COSÌDue
Può anche essere prodotto riscaldando vari solfuri nell'aria, bruciando minerali di pirite e minerali contenenti solfuri, tra gli altri..
Nel caso della pirite di ferro, quando ossidato, si ottengono ossido di ferro (iii) e SO.Due:
4 FeSDue + 11 ODue → 2 FeDueO3 + 8 SODue↑
Presenza in natura
Il SODue Viene rilasciato nell'atmosfera dall'attività dei vulcani (9%) ma è anche causato da altre attività naturali (15%) e dalle azioni umane (76%).
Le eruzioni vulcaniche esplosive causano fluttuazioni o variazioni annuali significative di SODue nell'atmosfera. Si stima che il 25% della SODue emessa dai vulcani viene spazzata via dalla pioggia prima di raggiungere la stratosfera.
Le fonti naturali sono le più abbondanti e sono dovute al ciclo biologico dello zolfo.
Nelle aree urbane e industriali predominano le fonti umane. La principale attività umana che lo produce è la combustione di combustibili fossili, come carbone, benzina e diesel. Altre fonti umane sono le raffinerie di petrolio, gli impianti chimici e la produzione di gas.

Nei mammiferi, viene generato in modo endogeno, cioè all'interno del corpo degli animali e dell'uomo, a causa del metabolismo degli amminoacidi contenenti zolfo (S), in particolare della L-cisteina..
Applicazioni
Nella produzione di acido solforico
Una delle applicazioni più importanti del sistema operativoDue sta nell'ottenere acido solforico HDueSW4.
2 SODue + 2 hDueO + ODue → 2 oreDueSW4
Nell'industria alimentare trasformata
L'anidride solforosa viene utilizzata come conservante e stabilizzante alimentare, come agente di controllo dell'umidità e come modificatore di gusto e consistenza in alcuni prodotti commestibili..
Viene anche utilizzato per disinfettare apparecchiature che entrano in contatto con alimenti, apparecchiature di fermentazione, come quelle di birrerie e cantine, contenitori per alimenti, ecc..
Permette di conservare frutta e verdura, aumenta la loro conservabilità, previene la perdita di colore e sapore e aiuta nella ritenzione di vitamina C (acido ascorbico) e caroteni (precursori della vitamina A).

È usato per conservare il vino, poiché distrugge batteri, funghi e lieviti indesiderati. Viene anche utilizzato per sterilizzare e prevenire la formazione di nitrosammine nella birra..

Viene anche utilizzato per immergere i chicchi di mais, per sbiancare lo zucchero di barbabietola e come antimicrobico nella produzione di sciroppo di mais ad alto contenuto di fruttosio..
Come solvente e reagente
È stato ampiamente utilizzato come solvente non acquoso. Sebbene non sia un solvente ionizzante, è utile come solvente privo di protoni per alcune applicazioni analitiche e reazioni chimiche..
È usato come solvente e reagente nella sintesi organica, un intermedio nella produzione di altri composti come il biossido di cloro, il cloruro di acetile e nella solfonazione degli oli..
Come agente riducente
Viene utilizzato come agente riducente nonostante non sia così forte, e in soluzione alcalina si forma lo ione solfito, che è un agente riducente più energico..
In varie applicazioni
Il SODue viene utilizzato anche:
- In agricoltura come fungicida e conservante per l'uva dopo la vendemmia.
- Per fare idrosolfiti.
- Per candeggiare pasta di legno e carta, in quanto permette di stabilizzare la polpa dopo la sbianca con acqua ossigenata HDueODue; il SODue agisce distruggendo l'HDueODue residuo e quindi mantenere la lucentezza della polpa, poiché l'HDueODue può causare un'inversione di luminosità.
- Per sbiancare le fibre tessili e gli articoli in vimini.
- Per trattare l'acqua in quanto elimina il cloro residuo che rimane dopo la clorazione dell'acqua potabile, acque reflue o industriali.
- Nella raffinazione di minerali e metalli, come agente riducente del ferro durante la lavorazione dei minerali.
- Nella raffinazione del petrolio per intrappolare l'ossigeno e ritardare la corrosione e come solvente di estrazione.
- Come antiossidante.
- Come neutralizzante alcalino nella produzione del vetro.
- Nelle batterie al litio come agente ossidante.
Effetti del sistema operativoDue endogeno
Alcuni studi hanno rivelato che SODue endogeno o prodotto dall'organismo stesso ha un effetto benefico sul sistema cardiovascolare, compresa la regolazione della funzione cardiaca e il rilassamento dei vasi sanguigni.
Quando la SO viene prodotta nel corpoDue diventa i suoi derivati bisolfito HSO3- e solfito SO3Due-, che esercitano un effetto vaso-rilassante sulle arterie.
Il SODue abbassa endogenamente l'ipertensione, previene lo sviluppo di aterosclerosi e protegge il cuore dai danni al miocardio. Ha anche un'azione antiossidante, inibisce l'infiammazione e l'apoptosi (morte cellulare programmata).
Per questi motivi si pensa che possa essere una possibile nuova terapia per le malattie cardiovascolari..
Rischi
- Esposizione a SODue gassoso può provocare ustioni a occhi, pelle, gola e mucose, danni ai bronchi e ai polmoni.
- Alcuni studi riportano che ha un potenziale rischio di danni al materiale genetico di cellule di mammiferi e umane.
- È corrosivo. Non è infiammabile.
Ecotossicità
L'anidride solforosa è il gas inquinante più diffuso nell'atmosfera, soprattutto nelle aree urbane e industriali..
La sua presenza nell'atmosfera contribuisce alla cosiddetta “pioggia acida” dannosa per gli organismi acquatici, i pesci, la vegetazione terrestre e la corrosione dei materiali di origine umana..

Il SODue è tossico per i pesci. Le piante verdi sono estremamente sensibili a SODue atmosferico. Erba medica, cotone, orzo e grano sono danneggiati a bassi livelli ambientali, mentre patate, cipolle e mais sono molto più resistenti.
Effetti dell'ingestione con il cibo
Sebbene sia innocuo per le persone sane, se utilizzato nelle concentrazioni consigliate dalle agenzie sanitarie autorizzate, SODue può indurre l'asma nelle persone sensibili che lo ingeriscono con il cibo.
Gli alimenti che di solito lo contengono sono frutta secca, bibite artificiali e bevande alcoliche.
Riferimenti
- NOI. Biblioteca nazionale di medicina. (2019). Diossido di zolfo. Recupero da pubchem.ncbi.nlm.nih.gov.
- Huang, Y. et al. (2016). Anidride solforosa endogena: un nuovo membro della famiglia dei gasotrasmettitori nel sistema cardiovascolare. Oxid Med Cell Longev. 2016; 2016: 8961951. Recupero da ncbi.nlm.nih.gov.
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Windholz, M. et al. (editori) (1983). L'indice Merck. Un'enciclopedia di prodotti chimici, farmaci e biologici. Decima edizione. Merck & CO., Inc.
- Pan, X. (2011). Ossidi di zolfo: fonti, esposizioni ed effetti sulla salute. Effetti sulla salute degli ossidi di zolfo. In Encyclopedia of Environmental Health. Recupero da sciencedirect.com.
- Tricker, R. e Tricker, S. (1999). Inquinanti e contaminanti. Diossido di zolfo. In Requisiti ambientali per apparecchiature elettromeccaniche ed elettroniche. Recupero da sciencedirect.com.
- Bleam, W. (2017). Chimica acido-base. Ossidi di zolfo. In chimica del suolo e dell'ambiente (seconda edizione). Recupero da sciencedirect.com.
- Freedman, B.J. (1980). Anidride solforosa negli alimenti e nelle bevande: il suo utilizzo come conservante e il suo effetto sull'asma. Br J Dis Chest. 1980; 14 (2): 128-34. Recupero da ncbi.nlm.nih.gov.
- Craig, K. (2018). Una revisione della chimica, dell'uso di pesticidi e del destino ambientale dell'anidride solforosa, come utilizzato in California. In Review of Environmental Contamination and Toxicology. Volume 246. Recuperato da link.springer.com.


Nessun utente ha ancora commentato questo articolo.