
Razionale, tecniche e usi della colorazione delle spore

Il colorazione delle spore È la metodologia utilizzata per colorare le strutture di resistenza che formano alcuni generi batterici quando si trovano in condizioni sfavorevoli; queste strutture corrispondono a una forma di sopravvivenza.
Ci sono molti generi che formano spore; tuttavia, i principali sono Bacillus e Clostridium. Questi generi sono considerati più rilevanti perché hanno specie patogene per l'uomo..
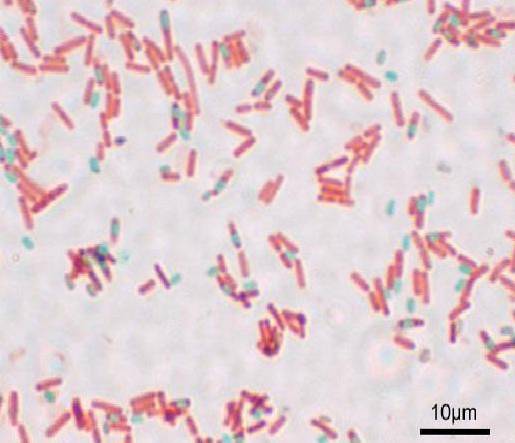
Ogni bacillo può dare origine a una spora. Al momento della colorazione del preparato, la spora può essere trovata all'interno del bacillo (endospora) o al di fuori di esso (esospora). Con le tecniche di colorazione convenzionali per i batteri, come la colorazione di Gram, le spore rimangono incolori.
Attualmente esistono diverse metodologie di colorazione che sono in grado di penetrare nella struttura spessa della spora per tingerla. Queste metodologie sono molto varie; Questi includono la tecnica Dorner, la colorazione Möeller e la metodologia Shaeffer-Fulton, nota anche come Wirtz-Conklin..
Di tutte le tecniche citate, la metodologia Shaeffer-Fulton è la più utilizzata nei laboratori di routine. Prende il nome da due microbiologi che hanno creato la colorazione nel 1930: Alicia Shaeffer e MacDonald Fulton. Tuttavia, la tecnica è talvolta chiamata Wirtz-Conklin in onore di due batteriologi del 1900..
Indice articolo
- 1 Razionale
- 2 Tecniche di colorazione delle spore
- 2.1 Tecnica di Dorner
- 2.2 Tecnica di Dorner modificata
- 2.3 Tecnica di Shaeffer-Fulton o Wirtz-Conklin
- 2.4 Tecnica di Möeller
- 2.5 Tecnica di Möeller modificata senza calore
- 3 usi
- 3.1 Esempi
- 4 Riferimenti
Base
Le spore non si macchiano con le macchie convenzionali perché hanno una parete molto spessa. La complessa composizione delle spore impedisce l'ingresso della maggior parte dei coloranti.
Se la spora viene studiata dall'esterno verso l'interno, si osservano i seguenti strati: il primo è l'esosporio, che è lo strato più sottile ed esterno formato dalle glicoproteine.
Segue la cuticola, che fornisce resistenza alle alte temperature, seguita dalla corteccia composta da peptidoglicano. Successivamente è il muro della base che protegge il protoplasto.
La spora è una struttura disidratata che contiene il 15% di calcio e acido dipicolinico. Per questo motivo, la maggior parte delle tecniche di colorazione delle spore si basa sull'applicazione di calore in modo che il colorante possa penetrare nella struttura spessa..
Una volta che la spora è macchiata, non può rimuovere il colorante. Nella tecnica Shaeffer-Fulton, il verde malachite entra nelle cellule vegetative e, quando viene applicato il calore, penetra anche nell'endospora e nelle esospore..
Lavando con acqua, il colorante viene rimosso dalla cellula vegetativa. Ciò si verifica perché il colorante verde malachite è leggermente basico, quindi si lega debolmente alla cellula vegetativa..
Invece, non può uscire dalle spore e il bacillo viene alla fine controcolorato con safranina. Questa base è valida per il resto delle tecniche, in cui accade qualcosa di simile.
Tecniche di colorazione delle spore
Per eseguire la colorazione delle spore, è necessario disporre di una coltura pura del ceppo sospetto che si desidera studiare..
La coltura viene sottoposta a temperature estreme per 24 ore per stimolare il microrganismo a sporulare. Per questo, la coltura può essere posta in forno a 44 ° C o in frigorifero (8 ° C) per 24 o 48 ore..
Se lasciato troppo a lungo alle temperature menzionate, si osserveranno solo le esospore, poiché tutte le endospore avranno già lasciato il bacillo.
Alla fine del tempo, posizionare alcune gocce di soluzione fisiologica sterile su un vetrino pulito. Quindi viene presa una piccola porzione della cultura e viene fatta una bella diffusione.
Viene quindi lasciato asciugare, posto al caldo e tinto con una delle tecniche spiegate di seguito:
Tecnica Dorner
1- Preparare una sospensione concentrata del microrganismo sporulato in acqua distillata in una provetta e aggiungere un volume uguale di Kinyoun carbol fuchsin filtrato.
2- Posizionare la provetta a bagnomaria bollente per 5-10 minuti.
3- Su un vetrino pulito, mescolare una goccia della sospensione precedente con una goccia di una soluzione acquosa al 10% di nigrosina, bollita e filtrata..
4- Stendere e asciugare rapidamente con calore delicato.
5- Esamina con un obiettivo 100X (immersione).
Le spore si colorano di rosso e le cellule batteriche appaiono quasi incolori su uno sfondo grigio scuro.
Tecnica di Dorner modificata
1- Una sospensione del microrganismo sporulato viene stesa su un vetrino e fissata al calore.
2- Il campione viene coperto con una striscia di carta da filtro a cui viene aggiunta fuchsina fenica. Il colorante viene riscaldato per 5-7 minuti con la fiamma del becco Bunsen fino a quando si genera l'evoluzione dei vapori. Quindi la carta viene rimossa.
3- Il preparato viene lavato con acqua e poi asciugato con carta assorbente.
4- Coprire lo striscio con una pellicola sottile di nigrosina al 10%, utilizzando un secondo vetrino per diffondere la nigrosina o un ago.
La colorazione che assumono le spore e i batteri è la stessa di quella descritta nella tecnica anteriore.
Tecnica Shaeffer-Fulton o Wirtz-Conklin
1- Fare uno striscio sottile con una sospensione del microrganismo sporulato su un vetrino e fissare al calore.
2- Coprire il vetrino con una soluzione acquosa di verde malachite al 5% (è possibile posizionare una carta da filtro sul vetrino).
3- Riscaldare sulla fiamma del becco Bunsen per provocare la fuoriuscita di vapori e allontanare la fiamma. Ripetere l'operazione per 6-10 minuti. Se la soluzione verde malachite evapora troppo durante la procedura, di più.
4- Rimuovere la carta da filtro (se installata) e lavare con acqua.
5- Coprire il vetrino con lo 0,5% di safranina acquosa per 30 secondi (alcune varianti della tecnica utilizzano lo 0,1% di safranina acquosa e lasciarlo per 3 minuti).
Con questa tecnica le spore appaiono verdi e i bacilli rossi..
Ha lo svantaggio che le endospore delle giovani culture non si macchiano bene, poiché appaiono estremamente chiare o incolori. Per evitare ciò, si consiglia di utilizzare colture di 48 ore di incubazione..
Tecnica di Möeller
1- Coprire lo striscio con cloroformio per 2 minuti.
2- Scartare il cloroformio.
3- Coprire con acido cromico al 5% per 5 minuti.
4- Lavare con acqua distillata
5- La sfoglia viene ricoperta con carbol fuchsin-fenicada ed esposta alla fiamma del becco Bunsen fino all'emissione di vapori; poi si toglie dal fuoco per qualche istante. L'operazione viene ripetuta fino al completamento di 10 minuti.
6- Lavare con acqua.
7- Utilizzare etanolo acidificato (alcol cloridrico) per scolorire. Lasciar agire per 20 o 30 secondi.
8- Lavare con acqua distillata.
9- Contrastare coprendo il telo con blu di metilene per 5 minuti.
10- Lavare con acqua distillata.
11- Lasciar asciugare e portare il campione al microscopio.
Le spore appaiono rosse e i bacilli blu. È importante non respirare i vapori, poiché sono tossici e possono essere cancerogeni a lungo termine..
Tecnica di Möeller modificata senza calore
Nel 2007 Hayama ei suoi collaboratori hanno creato una modifica della tecnica Möeller. Hanno eliminato la fase di riscaldamento del colorante e lo hanno sostituito aggiungendo 2 gocce del tensioattivo Tergitol 7 per ogni 10 ml di soluzione di carbol fuchsin-carbol. Sono stati ottenuti gli stessi risultati.
Applicazioni
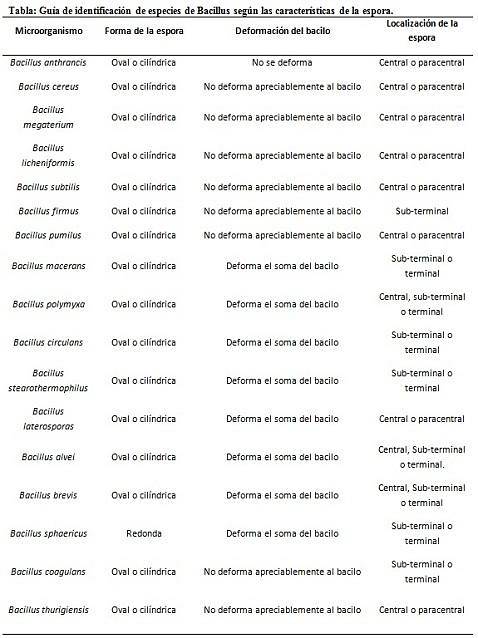
La colorazione delle spore fornisce informazioni molto preziose e utili per l'identificazione dell'agente patogeno, poiché la sua presenza, la sua forma, l'ubicazione all'interno del bacillo e la capacità di deformare o meno la cellula vegetativa, sono dati che possono guidare le specie coinvolte all'interno di un certo genere.
In questo contesto, vale la pena dire che le spore possono essere rotonde o ovali, possono essere situate al centro o anche in posizione paracentrale, subminale o terminale..
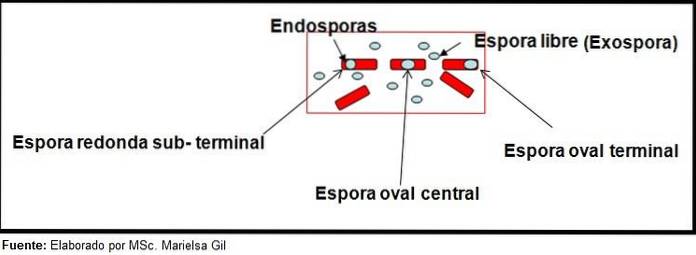
Esempi
- Clostridium difficile forma una spora ovale in posizione terminale che deforma il bacillo.
- La spora di Clostridium tertium è ovale, non deforma il bacillo e si trova a livello terminale.
- L'endospora di Clostridium tetani è terminale e deforma il bacillo, dando l'aspetto di una coscia.
- Spore di Clostridium botulinum, C. histolyticum, C. novy Y C. septicum sono subterminali rotonde od ovali e deformano il bacillo.
- L'endospora di Clostridium sordelli si trova in posizione centrale, con una leggera deformazione.
Riferimenti
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Proposta di una tecnica semplificata per la colorazione delle spore batteriche senza applicare la modifica con successo del calore del metodo di Moeller. Eur J Med Res. 2007; 16 12 (8): 356-9.
- Collaboratori di Wikipedia. Macchia di Moeller. Wikipedia, l'enciclopedia libera. 3 novembre 2018, 03:28 UTC. Disponibile su: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Manuale di laboratorio di tecniche microbiologiche. Dipartimento di Scienze di Base Accademia di Microbiologia. Istituto Politecnico Nazionale.
- "Endospora." Wikipedia, l'enciclopedia libera. 25 febbraio 2018, 10:20 UTC. 10 gennaio 2019, 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J e collaboratori. (2006). Personale operaio della comunità autonoma dell'Estremadura. Ordine del giorno specifico Volume IV. Editoriale MAD. Siviglia-Spagna, pagg. 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006) Tecnico specializzato di laboratorio, Galician Health Service (SERGAS). Argomento specifico ordine del giorno volume 2. Editoriale MAD. Siviglia-Spagna, pagg. 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosi microbiologica. (5a ed.). Argentina, Editoriale Panamericana S.A.
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scott Microbiological Diagnosis. 12 ed. Argentina. Editoriale Panamericana S.A



Nessun utente ha ancora commentato questo articolo.