
Cause di tensione superficiale, esempi, applicazioni ed esperimenti
Il tensione superficiale È una proprietà fisica che tutti i liquidi presentano ed è caratterizzata dalla resistenza che le loro superfici oppongono a qualsiasi aumento nella loro area. Questo equivale a dire che detta superficie cercherà l'area più piccola possibile. Questo fenomeno intreccia diversi concetti chimici, come coesione, adesione e forze intermolecolari..
La tensione superficiale è responsabile della formazione delle curvature superficiali dei liquidi nei contenitori tubolari (cilindri graduati, colonne, provette, ecc.). Questi possono essere concavi (curvi a forma di valle) o convessi (curvi a forma di cupola). Molti fenomeni fisici possono essere spiegati considerando i cambiamenti che subisce la tensione superficiale di un liquido..

Uno di questi fenomeni è la tendenza delle molecole liquide ad agglomerarsi sotto forma di gocce, quando poggiano su superfici che le respingono. Ad esempio, le gocce d'acqua che vediamo sopra le foglie, non possono bagnarle a causa della sua superficie cerosa e idrofobica..
Tuttavia, arriva un momento in cui la gravità gioca il suo ruolo e la goccia fuoriesce come una colonna d'acqua. Fenomeno simile si verifica in gocce sferiche di mercurio quando versate da un termometro.
D'altra parte, la tensione superficiale dell'acqua è la più importante di tutte, poiché contribuisce e organizza lo stato dei corpi microscopici in mezzi acquosi, come le cellule e le loro membrane lipidiche. Inoltre, questa tensione è responsabile del fatto che l'acqua evapora lentamente e alcuni corpi sono più densi di quanto possano galleggiare sulla sua superficie..
Indice articolo
- 1 Cause di tensione superficiale
- 2 unità
- 3 Tensione superficiale dell'acqua
- 4 Altri esempi
- 4.1 Gas condensati
- 4.2 Liquidi non polari
- 4.3 Liquidi polari
- 5 Applicazioni
- 5.1 Detergenti
- 5.2 Emulsioni
- 6 semplici esperimenti
- 6.1 Esperimento sulle clip
- 6.2 Barca di carta
- 7 Riferimenti
Cause di tensione superficiale
La spiegazione del fenomeno della tensione superficiale è a livello molecolare. Le molecole di un liquido interagiscono tra loro, in modo tale da essere coese nei loro movimenti irregolari. Una molecola interagisce con i suoi vicini accanto ad essa e con quelli sopra o sotto di essa.
Tuttavia, ciò non accade allo stesso modo con le molecole sulla superficie del liquido, che sono a contatto con l'aria (o qualsiasi altro gas), o con un solido. Le molecole sulla superficie non possono coesistere con quelle dell'ambiente esterno.
Di conseguenza, non subiscono alcuna forza che li tiri verso l'alto; solo verso il basso, dai suoi vicini nel mezzo liquido. Per contrastare questo squilibrio, le molecole di superficie "schiacciano", perché solo in questo modo riescono a vincere la forza che le spinge verso il basso.
Viene quindi creata una superficie in cui le molecole sono in una disposizione più tesa. Se una particella vuole penetrare nel liquido, deve prima attraversare questa barriera molecolare proporzionale alla tensione superficiale di detto liquido. Lo stesso vale per una particella che vuole sfuggire all'ambiente esterno dalle profondità del liquido..
Pertanto, la sua superficie si comporta come se fosse un film elastico che mostra resistenza alla deformazione..
Unità
La tensione superficiale è solitamente rappresentata dal simbolo γ, ed è espressa in unità N / m, forza per lunghezza. Tuttavia, la maggior parte delle volte la sua unità è il dyn / cm. Uno può essere convertito nell'altro dal seguente fattore di conversione:
1 din / cm = 0,001 N / m
Tensione superficiale dell'acqua
L'acqua è il più raro e il più sorprendente di tutti i liquidi. La sua tensione superficiale, così come molte delle sue proprietà, sono insolitamente elevate: 72 din / cm a temperatura ambiente. Questo valore può aumentare fino a 75,64 din / cm, a una temperatura di 0 ºC; o diminuire a 58.85 ºC, a una temperatura di 100 ºC.
Queste osservazioni hanno senso se si considera che la barriera molecolare si stringe ancora di più a temperature prossime al congelamento, oppure si "allenta" un po 'di più intorno al punto di ebollizione..
L'acqua ha un'elevata tensione superficiale a causa dei suoi legami idrogeno. Se questi di per sé sono evidenti all'interno del liquido, lo sono ancora di più in superficie. Le molecole d'acqua sono fortemente intrecciate, formando interazioni dipolo-dipolo di tipo H.DueOH, OH.

L'efficienza delle loro interazioni è tale che la barriera molecolare acquosa può persino supportare alcuni corpi prima che affondino. Nelle sezioni delle applicazioni e degli esperimenti, questo punto verrà ripreso.
Altri esempi
Tutti i liquidi presentano tensioni superficiali, in misura minore o maggiore dell'acqua, o siano sostanze o soluzioni pure. Quanto sono forti e tese le barriere molecolari delle sue superfici, dipenderà direttamente dalle loro interazioni intermolecolari, nonché da fattori strutturali ed energetici..
Gas condensati
Ad esempio, le molecole di gas allo stato liquido interagiscono tra loro solo attraverso le forze dispersive di Londra. Ciò è coerente con il fatto che le loro tensioni superficiali hanno valori bassi:
-Elio liquido, 0,37 din / cm a -273 ºC
-Azoto liquido, 8,85 din / cm a -196 ºC
-Ossigeno liquido, 13,2 din / cm a -182 ºC
La tensione superficiale dell'ossigeno liquido è superiore a quella dell'elio perché le sue molecole hanno una massa maggiore..
Liquidi apolari
Si prevede che i liquidi non polari e organici abbiano tensioni superficiali più elevate di questi gas condensati. Tra alcuni di loro abbiamo i seguenti:
-Etere dietilico, 17 din / cm a 20 ° C
-n-Esano, 18,40 din / cm a 20 ° C
-n-Ottano, 21,80 din / cm a 20 ° C
-Toluene, 27,73 din / cm a 25 ºC
Una tendenza simile si osserva per questi liquidi: la tensione superficiale aumenta all'aumentare delle loro masse molecolari. Comunque, il n-L'ottano dovrebbe, secondo questo, avere la tensione superficiale più alta e non il toluene. Qui entrano in gioco strutture e geometrie molecolari.
Le molecole di toluene, piatte e ad anello, hanno interazioni più efficaci di quelle di n-ottano. Pertanto, la superficie del toluene è "più stretta" della superficie di n-ottano.
Liquidi polari
Poiché esistono interazioni dipolo-dipolo più forti tra le molecole di un liquido polare, la loro tendenza è quella di mostrare tensioni superficiali più elevate. Ma non è sempre così. Tra alcuni esempi abbiamo:
-Acido acetico, 27,60 din / cm a 20 ° C
-Acetone, 23,70 din / cm a 20 ° C
-Sangue, 55,89 din / cm a 22 ° C
-Etanolo, 22,27 din / cm a 20 ° C
-Glicerolo, 63 din / cm a 20 ° C
-Cloruro di sodio fuso, 163 din / cm a 650 ° C
-Soluzione di NaCl 6 M, 82,55 din / cm a 20 ° C
Ci si aspetta che il cloruro di sodio fuso abbia un'enorme tensione superficiale: è un liquido ionico viscoso..
D'altra parte, il mercurio è uno dei liquidi con la più alta tensione superficiale: 487 din / cm. In esso, la sua superficie è composta da atomi di mercurio fortemente coesivi, molto più di quanto possano essere le molecole d'acqua..
Applicazioni

La tensione superficiale da sola non ha applicazioni. Tuttavia, questo non significa che non sia coinvolto in vari fenomeni quotidiani, che se non esistessero, non si verificherebbero..
Ad esempio, le zanzare e altri insetti sono in grado di camminare nell'acqua. Questo perché le loro gambe idrofobiche respingono l'acqua, mentre la loro massa ridotta consente loro di rimanere a galla sulla barriera molecolare senza cadere sul fondo del fiume, lago, stagno, ecc..
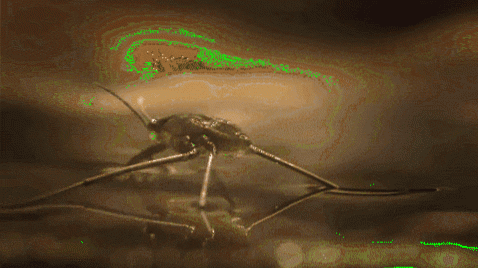
Anche la tensione superficiale gioca un ruolo nella bagnabilità dei liquidi. Maggiore è la sua tensione superficiale, minore è la sua tendenza a filtrare attraverso i pori o le fessure di un materiale. Oltre a questo, non sono liquidi molto utili per pulire le superfici.
Detersivi
È qui che agiscono i detergenti, riducendo la tensione superficiale dell'acqua, e aiutandola a coprire superfici più grandi; migliorando la sua azione sgrassante. Diminuendo la sua tensione superficiale, lascia spazio alle molecole d'aria, con cui forma le bolle..
Emulsioni
D'altra parte, le tensioni più basse sono legate alla stabilizzazione delle emulsioni, che sono molto importanti nella formulazione di una diversa gamma di prodotti..
Esperimenti semplici

Infine, verranno citate alcune sperimentazioni che possono essere svolte in qualsiasi spazio domestico..
Esperimento di clip
Una clip di metallo viene posta sulla sua superficie in un bicchiere di acqua fredda. Come si vede nell'immagine sopra, la clip rimarrà a galla grazie alla tensione superficiale dell'acqua. Ma se aggiungi un po 'di lava di terracotta al vetro, la tensione superficiale diminuirà drasticamente e la graffetta si abbasserà improvvisamente..
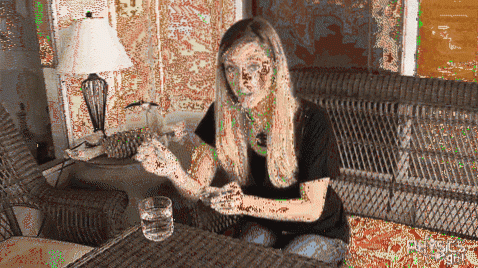
Barchetta di carta
Se sulla superficie abbiamo una barchetta di carta o un pallet di legno, e se la lavastoviglie o il detersivo vengono aggiunti alla testa di un tampone, si verificherà un fenomeno interessante: ci sarà una repulsione che li propagherà verso i bordi del bicchiere. La barchetta di carta e il pallet di legno si allontaneranno dal tampone imbrattato di detersivo.

Un altro esperimento simile e più grafico consiste nel ripetere la stessa operazione, ma in un secchio d'acqua spruzzato di pepe nero. Le particelle di pepe nero andranno alla deriva e la superficie cambierà da pepe ricoperto a cristallina, con il pepe sui bordi.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Wikipedia. (2020). Tensione superficiale. Estratto da: en.wikipedia.org
- USGS. (s.f.). Tensione superficiale e acqua. Estratto da: usgs.gov
- Jones, Andrew Zimmerman. (12 febbraio 2020). Tensione superficiale - Definizione ed esperimenti. Estratto da: thoughtco.com
- Susanna Laurén. (2017, 15 novembre). Perché la tensione superficiale è importante? Biolin Scientific. Estratto da: blog.biolinscientific.com
- Rookie Parenting Science. (7 novembre 2019). Cos'è la tensione superficiale | Cool Science Experiment. Estratto da: rookieparenting.com
- Jessica Munk. (2020). Esperimenti di tensione superficiale. Studia. Estratto da: study.com
- Il bambino dovrebbe vederlo. (2020). Sette esperimenti di tensione superficiale - Physics Girl. Estratto da: thekidshouldseethis.com



Nessun utente ha ancora commentato questo articolo.