
Struttura, proprietà, produzione, usi del solfuro di calcio (CaS)

Il solfuro di calcio È un solido inorganico formato dall'elemento calcio (Ca) e dall'elemento zolfo (S), la formula chimica è CaS. È un solido bianco-giallastro solubile in acqua, che si trova in natura in alcuni vulcani e in alcuni meteoriti sotto forma di un minerale chiamato oldhamite..
Quando CaS si dissolve in acqua, forma vari composti a causa dello ione solfuro SDue- diventa ione SH- e si formano ioni OH-. La soluzione risultante è alcalina. Questo composto viene utilizzato come base per composti luminescenti o che producono luce visibile in determinate condizioni. Questi materiali sono utilizzati anche nelle vernici luminose.

Il CaS è stato considerato come un possibile farmaco per trattare problemi cardiaci e dei vasi sanguigni come l'ipertensione o ipertensione, che è una malattia che colpisce gran parte della popolazione mondiale.
Con il solfuro di calcio si possono ottenere altri composti come il nitrato di calcio e il carbonato di calcio. Deve essere maneggiato con cautela ea contatto con l'umidità dell'atmosfera può produrre H.DueS che è molto tossico.
Indice articolo
- 1 Struttura
- 2 Nomenclatura
- 3 Proprietà fisiche
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Punto di fusione
- 3.4 Densità
- 3.5 Solubilità
- 4 Proprietà chimiche
- 4.1 Soluzione acquosa
- 4.2 Composti presenti quando disciolti in acqua
- 4.3 Reazione con acidi
- 4.4 Altre reazioni
- 5 Ottenimento
- 5.1 Presenza in natura
- 6 Usi
- 6.1 In materiali luminosi
- 6.2 In medicina
- 6.3 Nell'ottenere altri composti
- 6.4 Altre applicazioni
- 7 Rischi
- 8 Riferimenti
Struttura
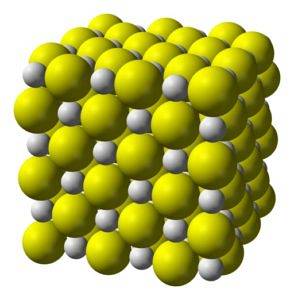
Il solfuro di calcio è un composto altamente ionico formato da uno ione calcio CaDue+ e uno ione solfuro SDue-.
Cristallizza in una struttura cubica come il salgemma.
Nomenclatura
- Solfuro di calcio
Proprietà fisiche
Stato fisico
Cristalli cubici solidi cristallini bianco-giallastri come quelli del cloruro di sodio.
Peso molecolare
72,144 g / mol
Punto di fusione
2528 ºC
Densità
2,59 g / cm3
Solubilità
Solubile in acqua. Insolubile in etanolo.
Proprietà chimiche
Soluzione acquosa
Quando CaS si dissolve in acqua, si separa nei suoi ioni calcio Ca. Due+ e zolfo SDue-. Quest'ultimo in acqua prende un protone e diventa lo ione idrosolfuro SH- rilasciando uno ione idrossile OH-.
SDue- + HDueO ⇔ SH- + Oh-
Pertanto, le soluzioni CaS di solfuro di calcio sono alcaline (hanno un pH basico) e non hanno ioni S.Due- ma SH-.
Solo quando una grande quantità di alcali come idrossido di sodio NaOH viene aggiunta alla soluzione, l'equilibrio si sposta verso la formazione di ioni solfuro SDue-.

Il SH- può prendere un altro protone H+ dall'acqua, formando acido solfidrico, che è un composto molto tossico.
SH- + HDueO ⇔ HDueS + OH-
Per questo motivo nell'acqua si formano piccole quantità di H.DueSì e se esposto all'umidità dell'ambiente, CaS emana un odore sgradevole tipico dell'idrogeno solforato.
Composti presenti quando disciolti in acqua
Il risultato delle reazioni in acqua sopra indicate è che si forma Ca (SH)Due, Ca (OH)Due e Ca (SH) (OH).
CaS + HDueO → Ca (SH) (OH)
Ca (SH) (OH) + HDueO → Ca (OH)Due + HDueS
Reazione con acidi
Le stesse reazioni che avvengono nell'acqua fanno sì che CaS reagisca con gli acidi formando H.DueS.
CaS + 2 HCl → CaClDue + HDueS
Altre reazioni
Se una soluzione di solfuro di calcio viene riscaldata con zolfo, si ottengono gli ioni polisolfuro S.4Due- e S3Due-.
Se CaS viene riscaldato in aria secca o ossigeno puro, il composto si ossida in solfito di calcio CaSO3 e poi al solfato di calcio CaSO4:
2 CaS + 3 ODue → 2 CaSO3
2 CaSO3 + ODue → 2 CaSO4
Con agenti ossidanti come il clorato di potassio KClO3, nitrato di potassio KNO3 o biossido di piombo PbODue si verificano reazioni violente.
Ottenere
Il solfuro di calcio può essere preparato calcinando (riscaldando ad altissima temperatura) gli elementi calcio (Ca) e zolfo (S) in atmosfera inerte, cioè non sono presenti ossigeno o vapore acqueo, ad esempio..
Ca + S + calore → CaS
Può anche essere ottenuto riscaldando solfato di calcio CaSO4 con carbone di legna:
Astuccio4 + 2 C → CaS + 2 CODue
Tuttavia, in quest'ultimo caso non si ottiene un CaS puro, poiché reagisce in aggiunta con CaSO4 formando CaO e SODue.
Il CaS viene anche generato bruciando rifiuti di carbone.
Presenza in natura
CaS è naturalmente presente nel minerale oldhamite. Questo è un componente di alcuni meteoriti ed è importante per la ricerca scientifica svolta sul sistema solare..
Si ritiene che la Oldhamite si sia formata dalla condensazione nella nebulosa che ha dato origine al sistema solare. È presente anche nei vulcani.

Inoltre, il solfuro di calcio è prodotto naturalmente dalla riduzione di CaSO4 (gesso) forse a causa dell'azione dei batteri.
Applicazioni
In materiali luminosi
Uno degli usi più diffusi del solfuro di calcio è stato come base per composti luminescenti. Queste sono sostanze che emettono luce visibile in determinate circostanze..
Nei composti luminescenti di CaS questo funge da base e alla struttura vengono aggiunti attivatori come i cloruri di alcuni elementi come il cerio (Ce3+) e europio (EuDue+).
Il materiale risultante dall'unione del CaS e dell'attivatore viene utilizzato ad esempio negli schermi a tubi catodici che compongono i vecchi schermi di computer o computer o vecchi televisori.

Sono anche utilizzati nelle attuali lampade a diodi emettitori di luce, o LED. Diodi emettitori di luce).

Questi materiali sono utilizzati anche in pitture e vernici luminose..
In medicina
Il solfuro di calcio è stato considerato in studi medico scientifici come farmaco per il trattamento della pressione alta (alta pressione nelle arterie). Questa è una malattia che colpisce il sistema cardiovascolare di molte persone (cuore e vasi sanguigni).
CaS è considerato un "donatore" di H.DueS. Questo gioca un ruolo importante nella regolazione del tono o della forza dei vasi sanguigni, quindi la somministrazione di CaS potrebbe essere un possibile rimedio per curare l'ipertensione.

Nell'ottenere altri composti
Il solfuro di calcio consente di preparare altri composti come il nitrato di calcio Ca (NO3)Due:
CaS + 2 HNO3 → Ca (NO3)Due + HDueS
È stato anche utilizzato per ottenere il carbonato di calcio CaCO3. Per fare ciò, una soluzione acquosa di CaS viene sottoposta a carbonatazione con CODue:
CaS + HDueO + CODue → HDueS + CaCO3
Altre app
Il solfuro di calcio è anche usato come additivo lubrificante e come agente di galleggiamento nell'estrazione di minerali..
Rischi
Il solfuro di calcio può causare irritazione alla pelle, agli occhi e alle vie respiratorie. Deve essere maneggiato con cautela e con un'attrezzatura di sicurezza adeguata.
È un composto molto tossico per la vita acquatica, quindi è pericoloso per questi ambienti.
Riferimenti
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Lide, D.R. (editore). (2005). Manuale CRC di chimica e fisica. 85th CRC Press.
- Ropp, R.C. (2013). Composti alcalino terrosi del gruppo 16 (O, S, Se, Te). Solfuro di calcio. In Encyclopedia of the Alkaline Earth Compounds. Recupero da sciencedirect.com.
- Li, Y.F. et al. (2009). Calcio solfuro (CaS), un donatore di idrogeno solforato (H (2) S): un nuovo farmaco antipertensivo? Med Hypotheses, 2009 settembre; 73 (3): 445-7. Recupero da ncbi.nlm.nih.gov.
- Casa J.E. e House, K.A. (2016). Zolfo, selenio e tellurio. Presenza di zolfo. In Descriptive Inorganic Chemistry (terza edizione). Recupero da sciencedirect.com.
- NOI. Biblioteca nazionale di medicina. (2019). Solfuro di calcio. Recupero da pubchem.ncbi.nlm.nih.gov.
- De Beer, M. et al. (2014). Conversione del solfuro di calcio in carbonato di calcio durante il processo di recupero dello zolfo elementare dai rifiuti di gesso. Gestione dei rifiuti, novembre 2014; 34 (11): 2373-81. Recupero da ncbi.nlm.nih.gov.


Nessun utente ha ancora commentato questo articolo.