
Caratteristiche ed esempio di capillarità in acqua
Il capillarità È una proprietà dei liquidi che consente loro di muoversi attraverso fori tubolari o superfici porose anche contro la forza di gravità. Per questo, ci deve essere l'equilibrio e la coordinazione di due forze legate alle molecole del liquido: coesione e adesione; questi due hanno una riflessione fisica chiamata tensione superficiale.
Il liquido deve poter bagnare le pareti interne del tubo o i pori del materiale attraverso cui viaggia. Ciò si verifica quando la forza di adesione (parete del tubo liquido-capillare) è maggiore della forza di coesione intermolecolare. Di conseguenza, le molecole del liquido creano interazioni più forti con gli atomi del materiale (vetro, carta, ecc.) Che tra loro..
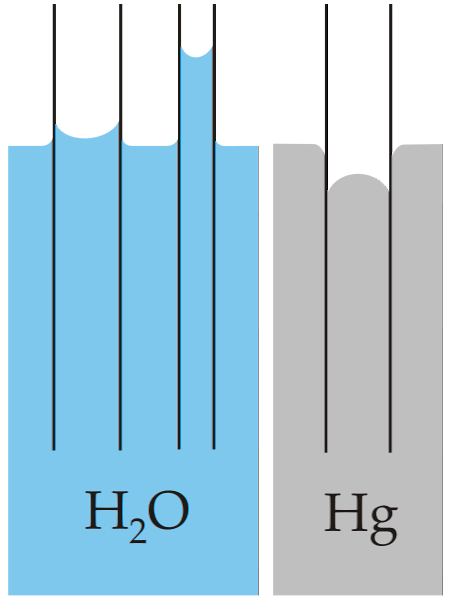
Il classico esempio di capillarità è illustrato confrontando questa proprietà per due liquidi molto diversi: acqua e mercurio..
Nell'immagine sopra, si può vedere che l'acqua sale sulle pareti del tubo, il che significa che ha maggiori forze di adesione; mentre con il mercurio avviene il contrario, perché le sue forze di coesione, di legame metallico, gli impediscono di bagnare il vetro.
Per questo motivo, l'acqua forma un menisco concavo e il mercurio un menisco convesso (a forma di cupola). Va anche notato che minore è il raggio del tubo o la sezione attraverso cui viaggia il liquido, maggiore è l'altezza o la distanza percorsa (confrontare le altezze delle colonne d'acqua per entrambi i tubi).
Indice articolo
- 1 Caratteristiche della capillarità
- 1.1 -Superficie del liquido
- 1.2 -Altezza
- 1.3 -Tensione superficiale
- 1.4 -Raggio del capillare o poro attraverso il quale sale il liquido
- 1.5 -Angolo di contatto (θ)
- 2 Capillarità dell'acqua
- 2.1 Nelle piante
- 3 Riferimenti
Caratteristiche di capillarità
-Superficie liquida
La superficie del liquido, per dire l'acqua, in un capillare è concava; cioè, il menisco è concavo. Questa situazione si verifica perché la risultante delle forze esercitate sulle molecole d'acqua vicino alla parete del tubo è diretta verso questo.
In ogni menisco è presente un angolo di contatto (θ), che è l'angolo formato dalla parete del tubo capillare con una linea tangente alla superficie del liquido nel punto di contatto.
Forze di adesione e coesione
Se la forza di adesione del liquido alla parete capillare prevale sulla forza di coesione intermolecolare, l'angolo è θ < 90º; el líquido moja la pared capilar y el agua asciende por el capilar, observándose el fenómeno conocido como capilaridad.
Quando una goccia d'acqua viene posta sulla superficie di un bicchiere pulito, l'acqua si diffonde sul vetro, quindi θ = 0 e cos θ = 1.
Se la forza di coesione intermolecolare prevale sulla forza di adesione della parete liquido-capillare, ad esempio nel mercurio, il menisco sarà convesso e l'angolo θ avrà un valore> 90º; il mercurio non bagna la parete dei capillari e quindi scorre lungo la sua parete interna.
Quando una goccia di mercurio viene posta sulla superficie di un vetro pulito, la goccia mantiene la sua forma e l'angolo θ = 140º.
-Altezza
L'acqua sale attraverso il tubo capillare fino a raggiungere un'altezza (h), in cui il peso della colonna d'acqua compensa la componente verticale della forza di coesione intermolecolare.
Man mano che più acqua si alza, arriverà un punto in cui la gravità interromperà la sua ascesa, anche con la tensione superficiale che lavora a tuo favore..
Quando ciò accade, le molecole non possono continuare a "arrampicarsi" sulle pareti interne e tutte le forze fisiche si equalizzano. Da una parte ci sono le forze che favoriscono la risalita dell'acqua, dall'altra il suo stesso peso la spinge verso il basso.
Legge di Jurin
Questo può essere scritto matematicamente come segue:
2 π rϒcosθ = ρgπrDueh
Dove la parte sinistra dell'equazione dipende dalla tensione superficiale, la cui grandezza è anche correlata alla coesione o forze intermolecolari; Cosθ rappresenta l'angolo di contatto er il raggio del foro attraverso il quale sale il liquido.
E sul lato destro dell'equazione abbiamo l'altezza h, la forza di gravità ge la densità del liquido; quale sarebbe l'acqua.
Risolvendo quindi per h abbiamo
h = (2ϒcosθ / ρgr)
Questa formulazione è nota come Legge di Jurin, che definisce l'altezza raggiunta dalla colonna di liquido, nel tubo capillare, quando il peso della colonna di liquido è bilanciato con la forza di ascensione per azione capillare..
-Tensione superficiale
L'acqua è una molecola dipolare, a causa dell'elettronegatività dell'atomo di ossigeno e della sua geometria molecolare. Ciò fa sì che la porzione della molecola d'acqua in cui si trova l'ossigeno si carichi negativamente, mentre la porzione della molecola d'acqua, contenente i 2 atomi di idrogeno, viene caricata positivamente..
Le molecole all'interno del liquido interagiscono grazie a questo attraverso molteplici legami idrogeno, tenendole insieme. Tuttavia, le molecole d'acqua che si trovano nell'interfaccia acqua: aria (superficie), sono soggette ad una netta attrazione da parte delle molecole del seno del liquido, non compensata dalla debole attrazione con le molecole d'aria.
Pertanto, le molecole d'acqua all'interfaccia sono soggette a una forza attrattiva che tende a rimuovere le molecole d'acqua dall'interfaccia; cioè i legami idrogeno formati con le molecole in basso trascinano quelle che si trovano in superficie. Pertanto, la tensione superficiale cerca di ridurre la superficie dell'acqua: interfaccia aria..
Rapporto con h
Se guardiamo all'equazione del diritto di Jurin, troveremo che h è direttamente proporzionale a ϒ; quindi, maggiore è la tensione superficiale del liquido, maggiore è l'altezza che può salire attraverso un capillare o poro di un materiale.
In questo modo si può prevedere che per due liquidi, A e B, con tensioni superficiali differenti, quello con tensione superficiale maggiore salga ad un'altezza maggiore..
Si può concludere rispetto a questo punto che un'elevata tensione superficiale è la caratteristica più importante che definisce la proprietà capillare di un liquido..
-Raggio del capillare o poro attraverso il quale sale il liquido
L'osservazione della Legge di Jurin indica che l'altezza che un liquido raggiunge in un capillare o poro è inversamente proporzionale al raggio dello stesso.
Pertanto, minore è il raggio, maggiore è l'altezza che la colonna di liquido raggiunge per capillarità. Questo può essere visto direttamente nell'immagine in cui l'acqua viene confrontata con il mercurio.
In un tubo di vetro con raggio di 0,05 mm di raggio, la colonna d'acqua per capillarità raggiungerà un'altezza di 30 cm. In tubi capillari con un raggio di 1 µm con una pressione di aspirazione di 1,5 x 103 hPa (che è pari a 1,5 atm) corrisponde ad un calcolo dell'altezza della colonna d'acqua da 14 a 15 m.
Questo è molto simile a quello che succede con quelle cannucce che si girano su se stesse più volte. Sorseggiando il liquido, si crea una differenza di pressione che fa salire il liquido alla bocca.
L'altezza massima della colonna raggiunta dalla capillarità è teorica, poiché il raggio dei capillari non può essere ridotto oltre un certo limite..
Legge di Poiseuille
Ciò stabilisce che il flusso di un liquido reale è dato dalla seguente espressione:
Q = (πr4/ 8ηl) ΔP
Dove Q è il flusso del liquido, η è la sua viscosità, l è la lunghezza del tubo e ΔP è la differenza di pressione.
Quando il raggio di un capillare diminuisce, l'altezza della colonna di liquido raggiunta dall'azione capillare dovrebbe aumentare indefinitamente. Tuttavia, Poiseuille sottolinea che al diminuire del raggio, diminuisce anche il flusso del liquido attraverso questo capillare..
Inoltre, la viscosità, che è una misura della resistenza al flusso di un liquido reale, diminuirebbe ulteriormente il flusso del liquido..
-Angolo di contatto (θ)
Maggiore è il valore di cosθ, maggiore è l'altezza della colonna d'acqua per capillarità, come indicato dalla Legge di Jurin.
Se θ è piccolo e si avvicina a zero (0), il cosθ è = 1, quindi il valore h sarà massimo. Al contrario, se θ è uguale a 90º, il cosθ = 0 e il valore di h = 0.
Quando il valore di θ è maggiore di 90º, come nel caso del menisco convesso, il liquido non sale per capillarità e la sua tendenza è di scendere (come accade con il mercurio).
Capillarità dell'acqua
L'acqua ha un valore di tensione superficiale di 72,75 N / m, relativamente elevato rispetto ai valori di tensione superficiale dei seguenti liquidi:
-Acetone: 22,75 N / m
-Alcool etilico: 22,75 N / m
-Esano: 18,43 N / m
-Metanolo: 22,61 N / m.
L'acqua ha quindi una tensione superficiale eccezionale, che favorisce lo sviluppo del fenomeno di capillarità tanto necessario per l'assorbimento di acqua e sostanze nutritive da parte delle piante..
Nelle piante

La capillarità è un meccanismo importante per la risalita della linfa attraverso lo xilema delle piante, ma è insufficiente da sola per portare la linfa alle foglie degli alberi..
La traspirazione o l'evaporazione è un meccanismo importante nell'ascesa della linfa attraverso lo xilema delle piante. Le foglie perdono acqua per evaporazione, generando una diminuzione della quantità di molecole d'acqua, che provoca un'attrazione delle molecole d'acqua presenti nei capillari (xilema).
Le molecole d'acqua non agiscono in modo indipendente l'una dall'altra, ma interagiscono dalle forze di Van der Waals, che le fa salire collegate tra loro attraverso i capillari delle piante verso le foglie.
Oltre a questi meccanismi, va notato che le piante assorbono l'acqua dal terreno per osmosi e che una pressione positiva generata nella radice, guida l'inizio della risalita dell'acqua attraverso i tubi capillari della pianta..
Riferimenti
- García Franco A. (2010). Fenomeni superficiali. Recupero da: sc.ehu.es
- Fenomeni superficiali: tensione superficiale e capillarità. [PDF]. Recupero da: ugr.es
- Wikipedia. (2018). Capillarità. Estratto da: es.wikipedia.org
- Risvhan T. (s.f.) Capillarità nelle piante. Estratto da: academia.edu
- Helmenstine, Anne Marie, Ph.D. (22 dicembre 2018). Azione capillare: definizione ed esempi. Estratto da: thoughtco.com
- Ellen Ellis M. (2018). Azione capillare dell'acqua: definizione ed esempi. Studia. Estratto da: study.com
- ScienceStruck Staff. (16 luglio 2017). Esempi che spiegano il concetto e il significato dell'azione capillare. Estratto da: sciencestruck.com



Nessun utente ha ancora commentato questo articolo.