
Qual è il punto di equivalenza ea cosa serve?
Il punto d'equivalenza È uno in cui due sostanze chimiche hanno reagito completamente. Nelle reazioni acido-base, questo punto indica quando un intero acido o base è stato neutralizzato. Questo concetto è il pane quotidiano delle titolazioni o valutazioni volumetriche, ed è determinato mediante semplici calcoli matematici.
Ma qual è il grado? È un processo in cui un volume di una soluzione di concentrazione nota, chiamata titolante, viene accuratamente aggiunto a una soluzione di concentrazione sconosciuta, al fine di ottenere la sua concentrazione.

L'utilizzo di un indicatore di pH permette di conoscere il momento in cui termina la titolazione. L'indicatore viene aggiunto alla soluzione che si sta titolando per effettuare la quantificazione della concentrazione che si desidera conoscere. Un indicatore acido-base è un composto chimico il cui colore dipende dalla concentrazione di idrogeno o dal pH del mezzo..
Tuttavia, lo spostamento del colore dell'indicatore indica il punto finale della titolazione, ma non il punto di equivalenza. Idealmente, entrambi i punti dovrebbero coincidere; ma in realtà, il cambiamento di colore può avvenire entro poche gocce dopo che la neutralizzazione dell'acido o della base è stata completata..
Indice articolo
- 1 Qual è il punto di equivalenza?
- 1.1 Punto finale
- 2 Punto di equivalenza della titolazione di un acido forte con una base forte
- 3 Curva di titolazione base acido-forte debole
- 3.1 Fasi
- 3.2 Selezione dell'indicatore in base al punto di equivalenza
- 4 Riferimenti
Qual è il punto di equivalenza?
Una soluzione di un acido di concentrazione sconosciuta posta in un pallone può essere titolata aggiungendo lentamente una soluzione di idrossido di sodio di concentrazione nota utilizzando una buretta..
La selezione di un indicatore deve essere effettuata in modo tale che cambi colore nel punto in cui hanno reagito la stessa quantità di equivalenti chimici della soluzione titolante e della soluzione di concentrazione sconosciuta..
Questo è il punto di equivalenza, mentre il punto in cui un indicatore cambia colore è chiamato punto finale, dove termina la titolazione..
Punto finale
La ionizzazione o dissociazione dell'indicatore è rappresentata come segue:
HIn + HDueO <=> Nel- + H3O+
E quindi ha un Ka costante
Ka = [H3O+] [Nel-] / [HIn]
La relazione tra l'indicatore non dissociato (HIn) e l'indicatore dissociato (In-) determina il colore dell'indicatore.
L'aggiunta di un acido aumenta la concentrazione di HIn e produce il colore dell'indicatore 1. Nel frattempo, l'aggiunta di una base favorisce un aumento della concentrazione dell'indicatore dissociato (In-) (colore 2).
È auspicabile che il punto di equivalenza corrisponda al punto finale. A tale scopo, viene selezionato un indicatore con un intervallo di cambio colore che include il punto di equivalenza. Inoltre, cerca di ridurre eventuali errori che producono una differenza tra il punto di equivalenza e il punto finale.
La standardizzazione o titolazione di una soluzione è un processo in cui viene determinata l'esatta concentrazione di una soluzione. È metodologicamente una laurea, ma la strategia seguita è diversa.
Una soluzione dello standard primario viene posta nel pallone e la soluzione titolante che viene standardizzata viene aggiunta con una buretta..
Punto di equivalenza della titolazione di un acido forte con una base forte
Nel pallone vengono posti 100 mL di HCl 0,1 M e una soluzione di NaOH 0,1 M viene gradualmente aggiunta attraverso una buretta, determinando le variazioni di pH della soluzione che origina l'acido cloridrico.
Inizialmente, prima di aggiungere NaOH, il pH della soluzione di HCl è 1.
Viene aggiunta la base forte (NaOH) e il pH aumenta gradualmente, ma è ancora un pH acido, poiché l'acido in eccesso determina questo pH.
Se continui ad aggiungere NaOH, arriva un momento in cui viene raggiunto il punto di equivalenza, in cui il pH è neutro (pH = 7). L'acido ha reagito con la base consumata, ma non c'è ancora base in eccesso.
La concentrazione di cloruro di sodio, che è un sale neutro (né Na+ né il Cl- idrolizzare).
Se si continua ad aggiungere NaOH, il pH continua ad aumentare, diventando più basico del punto di equivalenza, perché predomina la concentrazione di NaOH..
Idealmente il cambiamento di colore dell'indicatore dovrebbe avvenire a pH = 7; ma a causa della forma netta della curva di titolazione, è possibile utilizzare la fenolftaleina che cambia in un colore rosa pallido a un pH intorno a 8.
Curva di titolazione base acido-forte debole
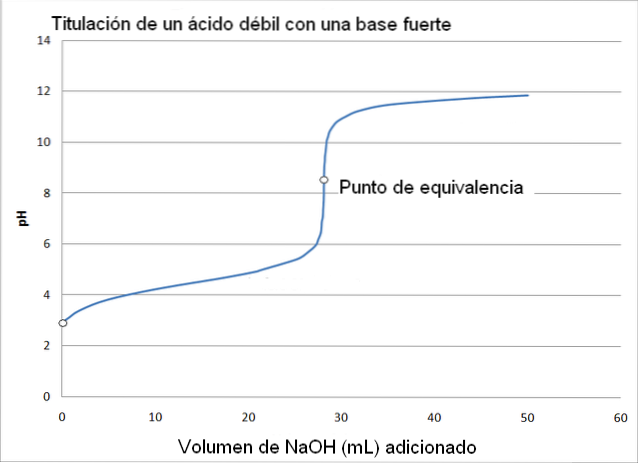
In questo caso, un acido debole, come l'acido acetico (CH3COOH) con una base forte, idrossido di sodio (NaOH). La reazione che si verifica nella titolazione può essere delineata come segue:
NaOH + CH3COOH => CH3COO-N / A+ + HDueO
In questo caso, il tampone acetato è formato con un pKa = 4,74. La regione tamponata può essere vista nella leggera e quasi impercettibile variazione prima del pH 6.
Il punto di equivalenza, come indica l'immagine, è intorno a 8,72 e non 7. Perché? Perché il CH3COO- è un anione che dopo l'idrolisi genera OH-, che basa il pH:
CH3COO- + HDueO <=> CH3COOH + OH-
Fasi
La titolazione dell'acido acetico mediante idrossido di sodio può essere suddivisa in 4 fasi per l'analisi.
-Prima di iniziare ad aggiungere la base (NaOH), il pH della soluzione è acido e dipende dalla dissociazione dell'acido acetico.
-Man mano che si aggiunge idrossido di sodio, si forma la soluzione tampone acetato, ma allo stesso modo aumenta la formazione della base coniugata acetato, che porta con sé un aumento del pH della soluzione..
-Il pH del punto di equivalenza si verifica a un pH di 8,72, che è francamente alcalino..
Il punto di equivalenza non ha un valore costante e varia a seconda dei composti coinvolti nella titolazione..
-Man mano che si continua ad aggiungere NaOH, dopo aver raggiunto il punto di equivalenza, il pH aumenta a causa di un eccesso di idrossido di sodio.
Selezione dell'indicatore in base al punto di equivalenza
La fenolftaleina è utile per determinare il punto di equivalenza in questa titolazione, perché ha il suo punto di svolta del colore a un pH intorno a 8, che cade nella zona del pH della titolazione dell'acido acetico che include l'equivalenza del punto (pH = 8,72).
D'altra parte, il rosso metile non è utile per determinare il punto di equivalenza, poiché cambia colore nell'intervallo di pH compreso tra 4,5 e 6,4.
Riferimenti
- Wikipedia. (2018). Punto d'equivalenza. Estratto da: es.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (22 giugno 2018). Definizione del punto di equivalenza. Estratto da: thoughtco.com
- Lusi Madisha. (16 aprile 2018). Differenza tra endpoint e punto di equivalenza ". DifferenceBetween.net. Recupero da: differencebetween.net
- Guarda J. (2018). Punto di equivalenza: definizione e calcolo. Estratto da: study.com
- Whitten, K. W., Davis, R. E., Peck, L. P. e Stanley, G. G. Chimica. (2008) Ottava edizione. Cengage Learning Editors.



Nessun utente ha ancora commentato questo articolo.