
Classificazione, fasi ed esempi dei sistemi dei materiali
Il sistemi materiali Sono tutti quelli che sono composti di materia e che sono isolati dal resto dell'universo da studiare. La materia è ovunque, dà forma e significato reale alle percezioni della vita quotidiana, ma quando si vuole studiare una porzione della materia, il suo ambiente è disprezzato e si parla di un sistema materiale..
Sono molto variabili, poiché esistono materiali puri e compositi, nonché diversi stati e fasi di aggregazione. Come definire il confine tra il sistema materiale e l'ambiente circostante? Tutto dipende dalle variabili considerate. Ad esempio, nell'immagine sotto ogni biglia di caramelle potrebbe essere il sistema in esame..

Tuttavia, se si deve tenere conto della variabile del colore, è necessario considerare tutte le biglie nel distributore automatico. Poiché la macchina non interessa, questo è l'ambiente dei marmi. Pertanto, il sistema materiale dell'esempio risulta essere la massa dei marmi e le loro proprietà (che siano gomme da masticare, menta, ecc.).
Tuttavia, chimicamente, i sistemi materiali sono definiti come qualsiasi sostanza pura o una loro miscela, classificata in base ai loro aspetti fisici..
Indice articolo
- 1 Classificazione
- 1.1 Sistema di materiale omogeneo
- 1.2 Sistema di materiali eterogeneo
- 2 fasi
- 2.1 Diagramma di fase
- 3 esempi
- 4 Riferimenti
Classificazione
Sistema di materiale omogeneo
La materia in esame può presentare un aspetto uniforme, in cui le sue proprietà rimangono costanti indipendentemente dal campione analizzato. In altre parole: questo tipo di sistema è caratterizzato dall'avere una sola fase della materia a prima vista.
Sostanza e composti puri
Se viene analizzata una sostanza pura, si troverà che le proprietà fisico-chimiche coincidono negli stessi valori e risultati, anche se vengono prelevati molti campioni (e in diverse aree geografiche)..
Ad esempio, se un campione di calcio fosse confrontato con uno proveniente da Asia, Europa, Africa e America, avrebbero tutti le stesse proprietà. Lo stesso accadrebbe se si prelevasse un campione di carbonio puro.
D'altra parte, anche un composto puro manifesta quanto sopra. Se fosse garantito che un'ardesia è composta da un unico e unico materiale, sarebbe classificata come un sistema di materiali omogenei.
Tuttavia, questo non si verifica per un campione minerale, poiché in generale ospita impurità da altri minerali associati, e per questo caso si tratta di un sistema materiale eterogeneo. Allo stesso modo, quei sistemi materiali come alberi, pietre, montagne o fiumi rientrano in quest'ultima classificazione..
Scioglimento
L'aceto commerciale è una soluzione acquosa al 5% di acido acetico; ovvero, 5 mL di acido acetico puro vengono sciolti in 100 mL di acqua. Tuttavia, il suo aspetto è di un liquido trasparente, sebbene in realtà si tratti di due composti puri (acqua e acido acetico) combinati.
Sistema materiale eterogeneo
A differenza di quello omogeneo, in questa classe di sistemi né l'aspetto né le proprietà sono costanti, essendo irregolari in tutta la sua estensione..
Inoltre può essere sottoposto a tecniche di separazione fisica o chimica, dalle quali si estraggono fasi considerate ciascuna come un sistema omogeneo..
Fasi
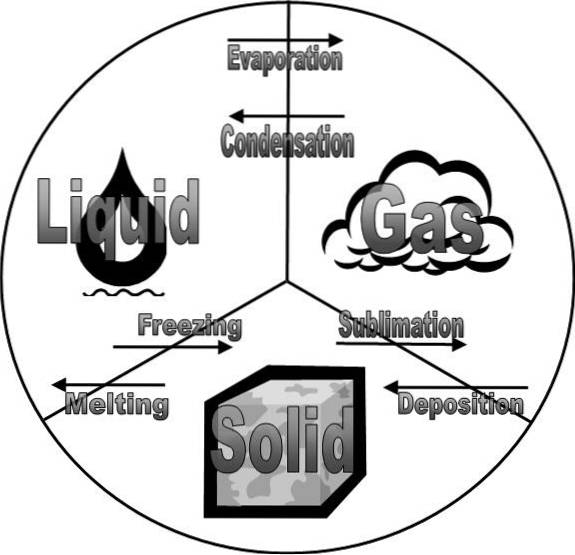
L'immagine in alto mostra gli stati della materia e i loro cambiamenti. Questi sono strettamente legati alle fasi della materia perché, sebbene siano uguali, presentano alcune sottili differenze..
Stando così le cose, le fasi di un sistema materiale sono solido, liquido e gas. In altre parole, per alcuni argomenti sottoposti ad analisi, può adottare una qualsiasi delle fasi precedenti.
Tuttavia, poiché le interazioni nei solidi sono molto forti e dipendono da variabili come pressione e temperatura, un sistema può o meno avere fasi solide diverse.
Ad esempio, il composto X, solido a temperatura ambiente, ha la fase I; ma quando la pressione su di esso è molto alta, le sue molecole si riorganizzano in modo più compatto, e quindi avviene una transizione dalla fase I alla fase solida II..
Esistono anche altre fasi, come la III e IV, che derivano dalla II a temperature diverse. Pertanto, il sistema materiale omogeneo di X di una fase solida apparente può acquisire fino a quattro fasi solide: I, II, III e IV.
Nel caso di sistemi liquido e gassoso, generalmente le molecole possono adottare solo una singola fase in questi stati della materia. In altre parole, potrebbero non esserci una fase gassosa I e una fase gassosa II..
Diagramma di fase
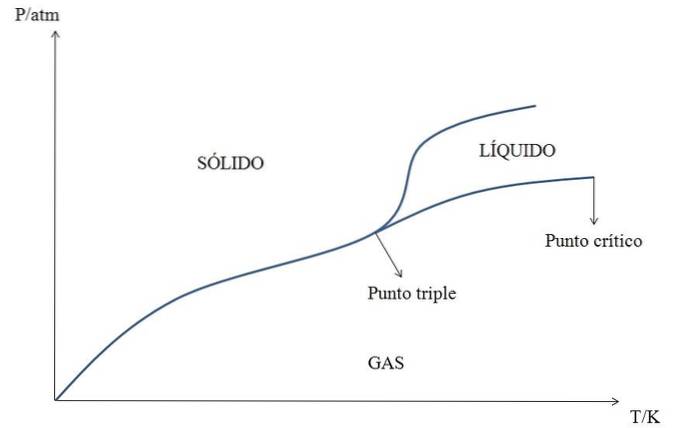
Ci sono molti diagrammi di fase: alcuni per un singolo composto o sostanza (come quello nell'immagine sopra), e altri per sistemi binari (un sale nell'acqua, per esempio) o ternari (tre componenti).
Il più "semplice" di tutti è il diagramma di fase di una sostanza. Quindi, per l'ipotetica sostanza Y, la sua fase è rappresentata in funzione della pressione (asse y) e della temperatura (asse x).
A basse pressioni è un gas, indipendentemente dalla sua temperatura. Tuttavia, quando si aumenta la pressione, il gas Y viene depositato nel solido Y.
Tuttavia, a temperature superiori al punto critico Y il gas si condensa nel liquido Y, e se viene aumentata anche la pressione (si sale verticalmente attraverso il diagramma), il liquido si solidifica.
Ogni linea rappresenta l'equilibrio tra le due fasi che separa: solido-gas, liquido-gas, solido-liquido, liquido-solido e solido-liquido-gas nel punto triplo.
Inoltre, dal punto critico Y, non viene mostrata alcuna distinzione fisica tra la fase gassosa e la fase liquida: forma quello che è noto come fluido supercritico..
Esempi

- Un pallone è un sistema materiale, poiché il suo contenuto è gassoso e, quindi, ha una natura chimica; se il gas è meno denso dell'aria, il pallone si solleverà verso il cielo.
- Il sistema binario acqua-olio ha due fasi: una dell'acqua e l'altra, logicamente, dell'olio. L'insieme di entrambi è il sistema eterogeneo, mentre i singoli strati sono sistemi omogenei. Se si desidera estrarre l'olio, è necessario eseguire un'estrazione liquido-liquido con un solvente organico e volatile..
- Un sistema solido-solido può essere costituito da una miscela di zucchero bianco e zucchero di canna. Qui, la differenza di colore tra i cristalli rende questo caso un sistema eterogeneo.
- L'acqua di mare è un altro esempio di un sistema di materiale omogeneo. Consiste in una soluzione di molti ioni, responsabili del suo caratteristico sapore salato. Se un campione di acqua di mare dovesse evaporare in un contenitore, sedimenterebbe i sali bianchi al suo interno..
Riferimenti
- Un sistema e i suoi dintorni. Estratto il 27 maggio 2018 da: chem.libretexts.org
- Antonio de Ulloa. Sistemi di materiali. [PDF]. Estratto il 27 maggio 2018 da: 2.educarchile.cl
- Daniel J. Berger. (2001). Estratto il 27 maggio 2018 da: bluffton.edu
- Il sistema e l'ambiente circostante in chimica. Estratto il 27 maggio 2018 da: chemteam.info
- Helmenstine, Anne Marie, Ph.D. (6 febbraio 2018). Definizione di sistema aperto in chimica. Estratto il 27 maggio 2018 da: thoughtco.com
- Glen Research Center. Fasi della materia. Estratto il 27 maggio 2018 da: grc.nasa.gov
- Alison H. (2006-09-15). Lancio di palloncini. Estratto il 28 maggio 2018 da: flickr.com


Nessun utente ha ancora commentato questo articolo.