
Caratteristiche, struttura, funzioni della resistenza
Il resistere, Conosciuto anche come fattore secretorio specifico del tessuto adiposo (ADSF), è un ormone peptidico ricco di cisteina. Il suo nome è dovuto alla correlazione positiva (resistenza) che presenta all'azione dell'insulina. È una citochina che ha da 10 a 11 residui di cisteina.
È stato scoperto nel 2001 nelle cellule adipose (tessuto adiposo) di topi e nelle cellule immunitarie ed epiteliali di esseri umani, cani, maiali, ratti e diverse specie di primati..
Indice articolo
- 1 Caratteristiche generali
- 1.1 Nei topi
- 1.2 Negli esseri umani
- 2 Sinonimo
- 3 Scoperta
- 3.1 FIZZ3
- 3.2 ADSF
- 3.3 Resistin
- 4 strutture
- 5 funzioni
- 6 Malattie
- 7 Riferimenti
Caratteristiche generali
Resistin fa parte di una famiglia di molecole di tipo resistina (molecole simili alla resistenza, RELM). Tutti i membri della famiglia RELM presentano una sequenza N-terminale, che presenta il segnale di secrezione compreso tra 28 e 44 residui.
Hanno una regione o zona centrale variabile, con un'estremità terminale carbossilica, di un dominio che varia tra 57 e circa 60 residui, altamente conservati o conservati e abbondanti in cisteina.
Questa proteina è stata trovata in diversi mammiferi. La maggior parte dell'attenzione è stata rivolta alla resistenza secreta dai topi e presente negli esseri umani. Queste due proteine hanno dal 53 al 60% di somiglianza (omologie) nelle loro sequenze di amminoacidi..
Nei topi
In questi mammiferi, la principale fonte di resistina sono le cellule adipose o il tessuto adiposo bianco.
La resistenza nei topi è ricca di cisteina 11 kDa. Il gene per questa proteina si trova sull'ottavo (8) cromosoma. È sintetizzato come un precursore di 114 amminoacidi. Hanno anche una sequenza di segnale di 20 amminoacidi e un segmento maturo di 94 amminoacidi..
Strutturalmente la resistina nei topi ha cinque legami disolfuro e più β-spire. Può formare complessi di due molecole identiche (omodimeri) o formare proteine con strutture quaternarie (multimeri) di dimensioni diverse grazie ai legami disolfuro e non disolfuro.
Negli umani
La resistina umana si caratterizza per essere, come nei topi o in altri animali, una proteina peptidica ricca di cisteina, solo nell'uomo è di 12 kDa, con una sequenza matura di 112 aminoacidi.
Il gene per questa proteina si trova sul cromosoma 19. La fonte di resistina nell'uomo sono le cellule dei macrofagi (cellule del sistema immunitario) e il tessuto epiteliale. Circola nel sangue come una proteina dimerica di 92 aminoacidi legati da legami disolfuro.

Sinonimo
Resistina è conosciuta con più nomi, tra cui: proteina secreta ricca di cisteina FIZZ3 (proteina secreta ricca di cisteina FIZZ3), fattore secretorio specifico del tessuto adiposo (ADSF), fattore secretorio specifico del tessuto adiposo (ADSF), proteina ricca di C / EBP -proteina ricca di cisteina secreta specifica mieloide regolata da epsilone, proteina A12-alfa-simile secreta ricca di cisteina (proteina A12-alfa-simile 2 ricca di cisteina), RSTN, XCP1, RETN1, MGC126603 e MGC126609.
Scoperta
Questa proteina è relativamente nuova per la comunità scientifica. È stato scoperto indipendentemente da tre gruppi di scienziati all'inizio di questo secolo, che gli hanno dato nomi diversi: FIZZ3, ADSF e resistina..
FIZZ3
È stato scoperto nel 2000, nel tessuto polmonare infiammato. Sono stati identificati e descritti tre geni di topi e due geni omologhi di esseri umani associati alla produzione di questa proteina..
ADSF
Proteina scoperta nel 2001, grazie all'identificazione di un fattore di secrezione ricco di cistina (Ser / Cys) (ADSF) specifico del tessuto lipidico bianco (adiposi).
A questa proteina è stato assegnato un ruolo importante nel processo di differenziazione da cellule multipotenti ad adiposi maturi (adipogenesi).
Resistin
Sempre nel 2001, un gruppo di ricercatori ha descritto la stessa proteina ricca di cistina nel tessuto lipidico maturo dei topi, che hanno chiamato resistina per la sua resistenza all'insulina..
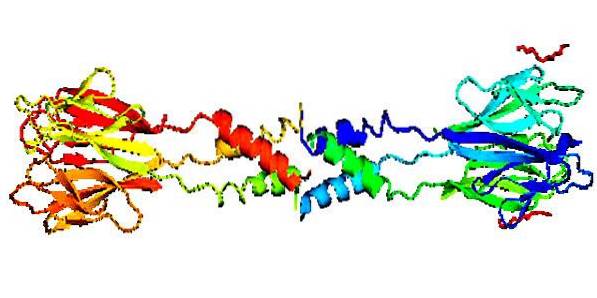
Strutture
Strutturalmente, è noto che questa proteina è costituita da un'area anteriore o di testa di forma laminare e da un'area posteriore (coda) di forma elicoidale, che formano oligomeri di diverso peso molecolare, a seconda che sia umano o di altra origine..
Ha una regione centrale con 11 residui di Ser / Cys (Serina / Cisteina) e un'area ricca anche di Ser / Cys la cui sequenza è CX11CX8CXCX3CX10CXCXCX9CCX3-6, dove C è Ser / Cys e X è un amminoacido qualsiasi.
Ha una composizione strutturale considerata insolita, poiché è formato da più subunità unite da interazioni non covalenti, cioè non utilizzano elettroni, ma variazioni elettromagnetiche disperse per comporre la loro struttura..
Caratteristiche
Le funzioni della resistina, ad oggi, sono oggetto di ampio dibattito scientifico. Tra i risultati più rilevanti degli effetti biologici negli esseri umani e nei topi ci sono:
- Diversi tessuti negli esseri umani e nei topi reagiscono alla resistina, inclusi fegato, muscoli, cuore, cellule immunitarie e adipose.
- I topi iperresistinemici (cioè con livelli elevati di resistina) sperimentano una ridotta autoregolazione del glucosio (omeostasi).
- La resistina riduce l'assorbimento di glucosio stimolato dall'insulina nelle cellule del muscolo cardiaco.
- Nelle cellule immunitarie (macrofagi) nell'uomo, la resistina induce la produzione di proteine che coordinano la risposta del sistema immunitario (citochine infiammatorie)
Malattie
Si ritiene che negli esseri umani questa proteina contribuisca fisiologicamente all'insulino-resistenza nel diabete mellito..
Il ruolo che gioca nell'obesità è ancora sconosciuto, anche se è stato scoperto che esiste una correlazione tra aumento del tessuto adiposo e livelli di resistina, ovvero l'obesità aumenta la concentrazione di resistina nel corpo. È stato anche dimostrato che è responsabile di alti livelli di colesterolo cattivo nel sangue.
La resistina modula le vie molecolari nelle patologie infiammatorie e autoimmuni. Provoca direttamente l'alterazione funzionale dell'endotelio, che a sua volta porta all'indurimento delle arterie noto anche come aterosclorosi.
Resistin funziona come indicatore della malattia e anche come strumento clinico predittivo per le malattie cardiovascolari. È coinvolto nella produzione di vasi sanguigni (angiogenesi), trombosi, asma, steatosi epatica non alcolica, malattia renale cronica, tra gli altri.
Riferimenti
- DC Juan, L.S. Kan, C.C. Huang, S.S. Chen, L.T. Ho, L.C. Au (2003). Produzione e caratterizzazione di resistina ricombinante bioattiva in Escherichia coli. Journal of Biotechnology.
- Resistenza umana. Pospec. Recupero da prospecbio.com.
- S. Abramson. Resistim. Recupero da collab.its.virginia.edu.
- G. Wolf (2004), Insulino-resistenza e obesità: resistina, un ormone secreto dal tessuto adiposo. Recensioni nutrizionali.
- M. Rodríguez Pérez (2014), Studio delle funzioni biologiche di S-Resistin. Rapporto presentato all'Università di Castilla-La Mancha, per richiedere il titolo di Dottore in Biochimica. 191.
- A. Souki, N.J. Arráiz-Rodríguez, C. Prieto-Fuenmayor,… C. Cano-Ponce (2018), Aspetti fondamentali nell'obesità. Barranquilla, Colombia: Edizioni dell'Università Simón Bolívar. 44 p.
- Md.S. Jamaluddin, S.M. Weakley, Q. Yao e C. Chen (2012). Resistina: ruoli funzionali e considerazioni terapeutiche per le malattie cardiovascolari. British Journal of Pharmacology.
- Ho resistito. Estratto da en.wikipedia.org.
- D.R. Schwartz, M.A. Lazar (2011). Resistenza umana: trovato nella traduzione da topo a uomo. Tendenze in endocrinologia e metabolismo.


Nessun utente ha ancora commentato questo articolo.