
Struttura, proprietà e usi dell'acido cloridrico (HCl)

Il acido cloridrico (HCl) o acido muriatico è un composto inorganico che si forma per dissoluzione in acqua di acido cloridrico, originando lo ione idronio (H3O+) e lo ione cloruro (Cl-). Più specificamente, è l'idracido del cloro alogeno con l'idrogeno.
HCl è un acido forte che ionizza completamente in acqua ei suoi prodotti di ionizzazione sono stabili. La completa ionizzazione di HCl è confermata dal fatto che il pH di una soluzione di HCl 0,1 M è 1.

Il metodo principale per la produzione industriale di HCl è la clorurazione di composti organici per produrre, ad esempio, diclorometano, tricloroetilene, percloroetilene o cloruro di vinile. HCl è un sottoprodotto della reazione di clorurazione.
Viene utilizzato nella titolazione di basi in numerose reazioni chimiche, nella digestione chimica di composti organici, ecc..
I vapori di acido cloridrico (acido cloridrico) possono ferire gravemente gli occhi. Inoltre, possono causare irritazione e gravi problemi alle vie respiratorie.
Il lume gastrico ha un pH acido (1-3) con un'alta concentrazione di HCl. La presenza acida favorisce la sterilizzazione del contenuto gastrico, inattivando numerosi batteri presenti nel cibo. Questo spiegherebbe la gastroenterite associata alla condizione di acloridria.
Inoltre, l'HCl facilita la digestione delle proteine attivando l'enzima proteolitico pepsina..
Viene utilizzato nella pulizia delle piscine, normalmente è sufficiente un comune detergente ma sono presenti macchie che aderiscono tra le piastrelle, richiedendo in questi casi l'uso di acido cloridrico.
È utilizzato nel controllo del pH in prodotti farmaceutici, alimenti e acqua potabile. Viene anche utilizzato nella neutralizzazione di flussi di rifiuti contenenti materiale alcalino..
L'acido cloridrico è utilizzato nella rigenerazione delle resine a scambio ionico, utilizzato per sequestrare ioni metallici o altri tipi di ioni nell'industria, nei laboratori di ricerca e nella purificazione dell'acqua potabile..
D'altra parte, si può anche commentare che l'acido cloridrico, un composto gassoso, è una molecola biatomica e gli atomi che lo formano sono uniti da un legame covalente. Nel frattempo, l'acido cloridrico è un composto ionico che in soluzione acquosa si dissocia in H.+ e Cl-. L'interazione tra questi ioni è elettrostatica..
Indice articolo
- 1 Struttura chimica
- 2 Formazione
- 3 Dove si trova?
- 3.1 Gastrina
- 3.2 Istamina
- 3.3 Acetilcolina
- 3.4 Altre fonti di HCl biologico
- 4 Proprietà fisiche e chimiche
- 4.1 Peso molecolare
- 4.2 Colore
- 4.3 Odore
- 4.4 Aroma
- 4.5 Punto di ebollizione
- 4.6 Punto di fusione
- 4.7 Solubilità in acqua
- 4.8 Solubilità in metanolo
- 4.9 Solubilità in etanolo
- 4.10 Solubilità in etere
- 4.11 Densità
- 4.12 Densità del gas
- 4.13 Densità del vapore
- 4.14 Pressione di vapore
- 4.15 Stabilità
- 4.16 Autoaccensione
- 4.17 Decomposizione
- 4.18 Corrosività
- 4.19 Tensione superficiale
- 4.20 Polimerizzazione
- 5 Usi
- 5.1 Industriale e domestico
- 5.2 Sintesi e reazioni chimiche
- 6 Rischi e tossicità
- 7 Prevenzione dei danni da acido cloridrico
- 8 Riferimenti
Struttura chimica
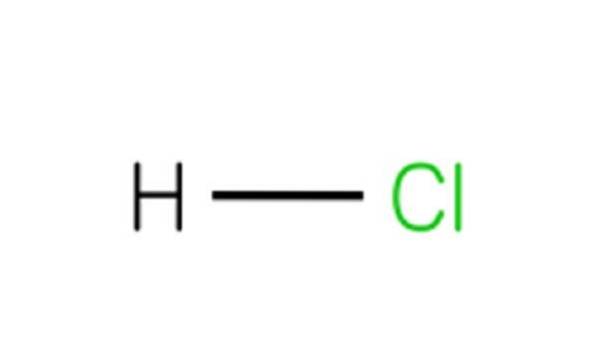
Ogni molecola di HCl è composta da un atomo di idrogeno e un atomo di cloro. Sebbene a temperatura ambiente l'HCl sia velenoso e un gas incolore, se si dissolve in acqua dà acido cloridrico..
Formazione

-Può essere prodotto per elettrolisi di NaCl (cloruro di sodio) che origina H.Due (g), clDue (g), 2Na (ac) e OH- (AC). Dopo:
HDue + ClDue => 2 HCl
Questa è una reazione esotermica.
-L'HCl viene prodotto facendo reagire il cloruro di sodio con l'acido solforico. Processo che può essere delineato nel modo seguente:
NaCl + HDueSW4 => NaHSO4 + HCl
Successivamente, si raccoglie l'acido cloridrico e si fa reagire il cloruro di sodio con il bisolfito di sodio secondo la seguente reazione:
NaCl + NaHSO4 => NaDueSW4 + HCl
Questa reazione è stata introdotta da Johan Glauber nel XVII secolo per produrre acido cloridrico. Attualmente è utilizzato principalmente nei laboratori, poiché l'importanza del suo uso industriale è diminuita.
-L'acido cloridrico può essere prodotto come sottoprodotto della clorurazione di composti organici, ad esempio: nella produzione di diclorometano.
CDueH4 + ClDue => CDueH4ClDue
CDueH4ClDue => CDueH3Cl + HCl
Questo metodo di produzione di HCl è più utilizzato a livello industriale, calcolando che il 90% dell'HCl prodotto negli Stati Uniti proviene da questa metodologia.
-E infine, l'HCl viene prodotto nell'incenerimento dei rifiuti organici clorurati:
C4H6ClDue + 5 ODue => 4 CODue + 2 hDueO + 2 HCl
Dove si trova?
L'acido cloridrico si concentra nel lume gastrico dove si raggiunge un pH 1. L'esistenza di una barriera mucosa, ricca di bicarbonato, impedisce alle cellule gastriche di subire danni a causa del basso pH gastrico..
Ci sono tre principali stimoli fisiologici per la secrezione di H.+ dalle cellule parietali del corpo gastrico: gastrina, istamina e acetilcolina.
Gastrina
La gastrina è un ormone secreto nella regione dell'antro gastrico che agisce aumentando la concentrazione intracellulare di Ca, intermediario nell'attivazione del trasporto attivo di H+ verso il lume gastrico.
Il trasporto attivo viene eseguito da un enzima ATPasi che utilizza l'energia contenuta nell'ATP per trasportare l'H+ verso il lume gastrico e introdurre K+.
Istamina
È secreto dalle cosiddette cellule enterocromaffini simili (SEC) del corpo gastrico. La sua azione è mediata da un aumento della concentrazione di AMP ciclico e agisce aumentando, come la gastrina, il trasporto attivo di H+ verso il lume gastrico mediato da una pompa H.+-K+.
Acetilcolina
Viene secreto dalle terminazioni nervose vagali, così come la gastrina media la sua azione da un aumento del Ca intracellulare, attivando l'azione della pompa H.+-K+.
La H+ delle cellule parietali proviene dalla reazione del CODue con l'HDueO per formare HDueCO3 (acido carbonico). Questo successivamente si decompone in H.+ e HCO3-. La H+ è attivamente trasportato al lume gastrico attraverso la membrana apicale gastrica. Nel frattempo, l'HCO3- viene portato nel sangue accoppiato all'ingresso di Cl-.
Il meccanismo di contro-trasporto o anti-trasporto Cl-HCO3- che si verifica nella membrana basale delle cellule parietali produce l'accumulo intracellulare di Cl-. Successivamente, lo ione passa nel lume gastrico accompagnando l'H+. Si stima che la secrezione gastrica di HCl abbia una concentrazione di 0,15 M..
Altre fonti di HCl biologico
Esistono altri stimoli per la secrezione di HCl da parte delle cellule parietali come la caffeina e l'alcol.
Le ulcere gastriche e duodenali si verificano quando la barriera che protegge le cellule gastriche dall'azione dannosa dell'HCl viene interrotta..
Eliminando la suddetta azione protettiva, i batteri Helicobacter pylori, l'acido acetilsalicilico e i farmaci antinfiammatori non steroidei (FANS) contribuiscono alla produzione di ulcere..
La secrezione acida ha la funzione di eliminare i microbi presenti negli alimenti e di avviare la digestione delle proteine, attraverso l'azione della pepsina. Le principali cellule del corpo gastrico secernono pepsinogeno, un proenzima che viene trasformato in pepsina dal basso pH del lume gastrico.
Proprietà fisiche e chimiche
Peso molecolare
36,458 g / mol.
Colore
È un liquido incolore o leggermente giallastro.
Odore
È un odore acre e irritante.
Gusto
La soglia per la degustazione è l'acqua pura è una concentrazione di 1,3 x 10-4 moli / l.
Punto di ebollizione
-121º F a 760 mmHg. Da -85,05 ° C a 760 mmHg.
Punto di fusione
-174 ° F (-13,7 ° F) per una soluzione di HCl al 39,7% p / p in acqua), -114,22 ° C.
Solubilità dell'acqua
La soluzione di HCl può essere del 67% p / p a 86 ° F; 82,3 g / 100 g di acqua a 0 ° C; 67,3 g / 100 g di acqua a 30 ° C e 63,3 g / 100 g di acqua a 40 ° C.
Solubilità in metanolo
51,3 g / 100 g di soluzione a 0 ° C e 47 g / 100 di soluzione a 20 ° C
Solubilità in etanolo
41,0 / 100 g di soluzione a 20 ° C
Solubilità in etere
24,9 g / 100 di soluzione a 20 ° C.
Densità
1,059 g / ml a 59 ° F in una soluzione al 10,17% p / p.
Densità del gas
1.00045 g / L
Densità del vapore
1.268 (in relazione all'aria presa come 1)
Pressione del vapore
32.452 mmHg a 70 ° F; 760 mmHg a -120,6º F
Stabilità
Ha un'elevata stabilità termica.
Autoaccensione
Non è infiammabile.
Decomposizione
Si decompone per forte riscaldamento emettendo fumo di cloro tossico.
Viscosità: 0,405 cPoise (liquido a 118,6 º K), 0,0131 cPoise (vapore a 273,06 º K).
Corrosività
È altamente corrosivo per alluminio, rame e acciaio inossidabile. Attacca tutti i metalli (mercurio, oro, platino, argento, tantalio tranne alcune leghe).
Tensione superficiale
23 mN / cm a 118,6º K.
Polimerizzazione
Le aldeidi e gli epossidi subiscono una violenta polimerizzazione in presenza di acido cloridrico.
Le proprietà fisiche, come viscosità, tensione di vapore, punto di ebollizione e punto di fusione sono influenzate dalla concentrazione percentuale p / p dell'HCl.
Applicazioni
L'acido cloridrico ha molti usi a casa, in diversi settori, nei laboratori di insegnamento e ricerca, ecc..
Industriale e domestico
-L'acido cloridrico è utilizzato nella lavorazione idrometallurgica, ad esempio nella produzione di allumina e biossido di titanio. Viene utilizzato nell'attivazione della produzione di pozzi petroliferi.
L'iniezione dell'acido aumenta la porosità intorno all'olio, favorendone l'estrazione..
-Viene utilizzato per la rimozione dei depositi di CaCO3 (carbonato di calcio) mediante la sua trasformazione in CaClDue (cloruro di calcio) che è più solubile e più facile da rimuovere. Allo stesso modo, viene utilizzato industrialmente nella lavorazione dell'acciaio, materiale dai molteplici usi e applicazioni, sia nell'industria, che nell'edilizia e in casa..
-I muratori usano soluzioni HCl per lavare e pulire i mattoni. Viene utilizzato in casa per la pulizia e la disinfezione dei bagni e dei relativi scarichi. Inoltre, l'acido cloridrico viene utilizzato nelle incisioni, comprese le operazioni di pulizia dei metalli..
-L'acido cloridrico trova applicazione nell'eliminazione dello strato di ossido di ferro ammuffito che si accumula sull'acciaio, prima della sua successiva lavorazione in estrusione, laminazione, zincatura, ecc..
FedeDueO3 + Fe + 6 HCl => 3 FeClDue + HDueO
-Nonostante sia altamente corrosivo, viene utilizzato per rimuovere le macchie di metallo presenti nel ferro, rame e ottone, utilizzando una diluizione 1:10 in acqua..
Sintesi e reazioni chimiche
-L'acido cloridrico viene utilizzato nelle reazioni di titolazione di basi o alcali, nonché nella regolazione del pH delle soluzioni. Inoltre, viene utilizzato in numerose reazioni chimiche, ad esempio nella digestione delle proteine, una procedura preliminare allo studio del contenuto di amminoacidi e alla loro identificazione..
-Un utilizzo principale dell'acido cloridrico è la produzione di composti organici, come il cloruro di vinile e il diclorometano. L'acido è un intermedio nella produzione di policarbonati, carbone attivo e acido ascorbico.
-È utilizzato nella produzione di colla. Mentre nell'industria tessile viene utilizzato nel candeggio dei tessuti. Viene utilizzato nell'industria conciaria delle pelli, intervenendo nella sua lavorazione. Trova anche impiego come fertilizzante e nella produzione di cloruri, coloranti, ecc. Viene anche utilizzato nella galvanica, nella fotografia e nell'industria della gomma..
-Viene utilizzato nella produzione della seta artificiale, nella raffinazione di olii, grassi e saponi. Inoltre, è utilizzato nelle reazioni di polimerizzazione, isomerizzazione e alchilazione..
Rischi e tossicità
Ha un'azione corrosiva sulla pelle e sulle mucose, provocando ustioni. Questi, se gravi, possono causare ulcerazioni, lasciando cicatrici cheloidi e retrattili. Il contatto con gli occhi può causare riduzione o perdita totale della vista a causa di danni alla cornea..
Quando l'acido raggiunge il viso può causare gravi cicli che deturpano il viso. Il contatto frequente con l'acido può anche causare dermatiti..
L'ingestione di acido cloridrico brucia la bocca, la gola, l'esofago e il tratto gastrointestinale, provocando nausea, vomito e diarrea. In casi estremi, può verificarsi perforazione dell'esofago e dell'intestino, con arresto cardiaco e morte..
D'altra parte, i vapori acidi, a seconda della loro concentrazione, possono causare irritazione delle vie respiratorie, provocando faringite, edema della glottide, restringimento dei bronchi con bronchite, cianosi ed edema polmonare (eccessivo accumulo di liquido nei polmoni) e in casi estremi, la morte.
L'esposizione ad alti livelli di fumi acidi può provocare gonfiore e spasmo alla gola con conseguente soffocamento..
Frequenti sono anche le necrosi dentali che compaiono nei denti con la perdita della loro lucentezza; diventano giallastri e molli, alla fine si rompono.
Prevenzione dei danni da acido cloridrico
Esiste una serie di regole per la sicurezza delle persone che lavorano con l'acido cloridrico:
-Le persone con una storia di malattie respiratorie e digestive non dovrebbero lavorare in ambienti con presenza di acido..
-I lavoratori devono indossare indumenti resistenti agli acidi, anche con cappucci; occhiali di protezione per gli occhi, protezioni per le braccia, guanti resistenti agli acidi e scarpe con le stesse caratteristiche. Devono inoltre indossare maschere antigas e in caso di grave esposizione ai vapori di acido cloridrico, si raccomanda l'uso di autorespiratori..
-L'ambiente di lavoro deve inoltre disporre di docce di emergenza e fontane per il lavaggio degli occhi..
-Inoltre, esistono norme per gli ambienti di lavoro, come il tipo di pavimento, circuiti chiusi, protezione delle apparecchiature elettriche, ecc..
Riferimenti
- StudiousGuy. (2018). Acido cloridrico (HCl): usi e applicazioni importanti. Tratto da: studiousguy.com
- Ganong, W. F. (2003). Revisione di fisiologia medica. Ventunesima edizione. The McGraw-Hill Companies INC.
- PubChem. (2018). Acido cloridrico. Tratto da: pubchem.ncbi.nlm.nih.gov
- Weebly. Acido cloridrico. Tratto da: psa-hydrochloric-acid.weebly.com
- CTR. Scheda dati di sicurezza dell'acido cloridrico. [PDF]. Tratto da: uacj.mx



Nessun utente ha ancora commentato questo articolo.