
Riduzione (chimica) in cosa consiste ed esempi

Il riduzione È tutta quella reazione chimica in cui gli atomi di uno dei reagenti finiscono per guadagnare elettroni; Cosa può essere visto anche in questo modo: il tuo posto vacante o il "disagio" elettronico è ridotto. Un atomo guadagna elettroni quando una specie li dona; cioè si arrugginisce.
Questo tipo di reazione non può avvenire da solo: se una specie accetta gli elettroni, un'altra deve necessariamente rinunciarvi. Altrimenti, la materia verrebbe creata dal nulla, riducendo gli atomi dopo aver guadagnato elettroni dal vuoto. Pertanto, è una mezza reazione redox (riduzione / ossidazione).
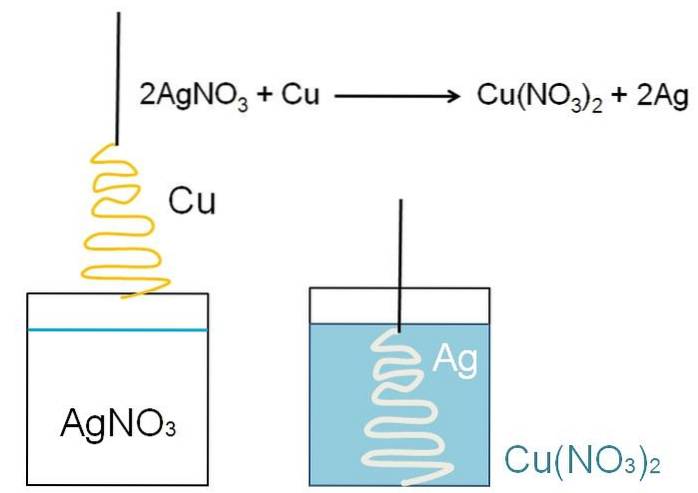
Un esempio illustrativo della riduzione che può essere mostrata nelle aule è la reazione tra una superficie metallica di rame e una soluzione acquosa di nitrato d'argento, AgNO3.
In soluzione, l'argento si trova come cationi Ag+, caricato positivamente. Questi, interagendo con la superficie del rame, a forma di albero di Natale, strappano gli elettroni dagli atomi di rame. Quando ciò si verifica, il rame sostituisce l'argento nel sale nitrato; e di conseguenza, nitrato di rame, Cu (NO3)Due.
Cationi CuDue+ accanto a NO3- trasformare la soluzione in bluastra; e argento, sbianca l'albero di Natale come se lo coprisse di neve.
Indice articolo
- 1 Qual è la riduzione?
- 1.1 Numero di ossigeno
- 1.2 Atomo elettronegativo
- 2 esempi
- 2.1 Riduzione della chimica organica
- 2.2 Estrazione del metallo
- 3 Riferimenti
Qual è la riduzione?
In riduzione è già stato detto che una specie guadagna elettroni. Come si può verificare questo in un'equazione chimica? Ad esempio, nell'equazione per la reazione tra Cu e AgNO3, Come sapere quando si verifica la riduzione? Per verificarlo, è necessario determinare il numero o lo stato di ossidazione.
Gli elementi nel loro stato naturale, hanno per definizione uno stato di ossidazione pari a zero, poiché si presume che non abbiano né perso né guadagnato elettroni. Pertanto, i metalli solidi hanno uno stato di ossidazione zero. Quindi, l'argento va da +1 (Ag+) a 0 (Ag). La carica di uno ione metallico è uguale al suo stato di ossidazione.
Gli elettroni invece provenivano dal rame: passando da 0 (Cu) a +2 (CuDue+). Anione nitrato, NO3- rimane invariato mentre entrambi i metalli si scambiano elettroni; pertanto, l'equazione può essere scritta come:
2Ag+ + Cu => 2Ag + CuDue+
Notare che sia le cariche che gli atomi sono bilanciati..
Ecco in cosa consiste la riduzione chimica: nel guadagno di elettroni che rendono gli stati di ossidazione degli atomi meno positivi di quelli degli elettroni..
Numero di ossigeno
Gli ossigeni sono atomi molto elettronegativi e ossidanti, quindi quando un atomo forma composti con loro (come gli ossidi), hanno stati di ossidazione positivi. Maggiore è il numero di ossigeni che interagiscono con l'atomo, più positivo sarà il suo stato di ossidazione; o qual è lo stesso, è più arrugginito.
Pertanto, quando un composto ha meno atomi di ossigeno, si dice che sia meno ossidato; cioè, l'atomo perde meno elettroni.
Un classico esempio può essere visto nel monossido di carbonio e nell'anidride carbonica. Per la CO, il carbonio ha uno stato di ossidazione di +2; mentre per il CODue, il suo stato di ossidazione è +4.
Quindi, se in una reazione il CODue si trasforma in CO, si dice che si sta verificando una riduzione; da allora, il carbonio ora interagisce con un ossigeno e non con due. Per la reazione opposta, la CO si trasforma in CODue, si parla di un'ossidazione del carbonio.
Questo vale per tutti gli atomi, specialmente i metalli nei loro ossidi metallici; ad esempio, CrODue (Cr4+) e CrO3 (Cr6+).
Nelle equazioni chimiche in cui una specie perde ossigeno mentre l'altra specie lo guadagna, si dice che si verifichi un trasferimento di ossigeno.
Atomo elettronegativo
È sempre possibile determinare se si è verificata una riduzione modificando lo stato di ossidazione su un valore meno positivo. Come appena spiegato, un modo rapido per notare senza nemmeno fare i conti è osservare se c'è una diminuzione degli atomi di ossigeno in un composto..
Lo stesso può accadere con qualsiasi altro atomo che sia più elettronegativo dell'atomo che guadagna o perde elettroni.
Ad esempio, se il CF4 reagisce in modo tale da diventare CH4, si dice allora che si è verificata una riduzione; poiché il fluoro è molto più elettronegativo dell'atomo di idrogeno. Di conseguenza, il carbonio è meno ossidato nel CH4 quello nel CF4, il che equivale a dire che è stato ridotto.
Esempi
Riduzione della chimica organica
L'esempio CF4 e CH4 riflette ciò che accade nelle reazioni organiche, dove la riduzione della carica parziale di un atomo è considerata un guadagno elettronico. Questo vale molto quando si considera la riduzione dei gruppi funzionali ossigenati..
Ad esempio, considera i gruppi ROH, RCHO e COOH. Il primo corrisponde agli alcoli, dove il carbonio si lega con l'ossigeno (C-OH); il secondo è il gruppo aldeidico, dove il carbonio forma un doppio legame con l'ossigeno ed è anche legato all'idrogeno (C = O-H); e il terzo è il gruppo carbossilico.
Nel gruppo carbossilico, il carbonio forma un doppio legame con un O e un legame singolo con un altro O (HO-C = O).
Pertanto, si verifica una riduzione se un acido carbossilico viene trasformato in un alcol:
RCOOH => ROH
Estrazione del metallo
La riduzione chimica è estremamente importante nei processi di estrazione dei metalli dai loro minerali. Alcune delle reazioni sono:
HgS + ODue => Hg + SODue
Il solfuro di mercurio è ridotto a mercurio metallico.
CuDueS + ODue => 2Cu + COSÌDue
Il solfuro di rame è ridotto a rame metallico.
2ZnS + 3ODue => 2ZnO + 2SODue
ZnO + C => Zn + CO (notare il trasferimento di O)
Il solfuro di zinco viene prima ridotto al suo monossido e poi alla sua forma metallica.
FedeDueO3 + 3CO => 2Fe + 3CODue
L'ossido ferrico è ridotto a ferro metallico.
WO3 + 3HDue => L + 3HDueO
E il triossido di tungsteno è ridotto a tungsteno metallico.
Come esercizio, è possibile determinare il numero di ossidazione del metallo prima che venga ridotto.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Chemistry LibreTexts. (9 dicembre 2018). Reazioni di ossidoriduzione. Recupero da: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (4 luglio 2018). La definizione di riduzione in chimica. Estratto da: thoughtco.com
- Hultzman R. (2019). Riduzione in chimica: definizione e panoramica. Studia. Estratto da: study.com
- Clark J. (2013). Definizioni di ossidazione e riduzione (redox). Estratto da: chemguide.co.uk
- Vista tutor. (s.f.). Reazione di riduzione. Estratto da: chemistry.tutorvista.com
Nessun utente ha ancora commentato questo articolo.