
Reazione endotermica ed esotermica

UN reazione endotermica richiede alimentazione mentre a reazione esotermica rilascia energia. Questa classificazione delle reazioni chimiche tiene conto della partecipazione dell'energia come reagente o come prodotto..
L'energia è la capacità di lavorare o di produrre calore. Ricorda che le reazioni chimiche comportano una riorganizzazione degli atomi tra sostanze con rottura o formazione di legami chimici. In generale, questa formazione o rottura di legami chimici è accompagnata da cambiamenti nell'energia del sistema..
| Reazione endotermica | Reazione esotermica | |
|---|---|---|
| Definizione | Reazione chimica in cui l'energia viene assorbita. | Reazione chimica in cui l'energia viene rilasciata sotto forma di calore. |
| Origine dell'energia | Dell'ambiente | Del sistema |
| Energia potenziale | Meno nei reagenti che nei prodotti. | Maggiore nei reagenti che nei prodotti. |
| Produzione | Non spontaneo | Spontaneo |
| Cambiamento di energia interna | ΔE> 0; variazione di energia interna maggiore di zero. | ΔE<0; cambio de energía interna menor que cero. |
| Temperatura | Diminuisce | Aumenta |
| Esempi | Reazioni nella fotosintesi e sintesi in generale. | Un fiammifero acceso, reazioni di combustione. |
Cos'è una reazione endotermica?
Una reazione chimica è endotermica quando assorbe energia dall'ambiente. In questo caso il calore viene trasferito dall'esterno all'interno dell'impianto. Quando posizioniamo un termometro mentre è in corso la reazione endotermica, la temperatura diminuisce.
La parola "endotermico" deriva dal greco endon che significa "dentro" e therme che significa "calore". Le reazioni endotermiche non procedono spontaneamente.
Da dove viene l'energia nelle reazioni endotermiche?
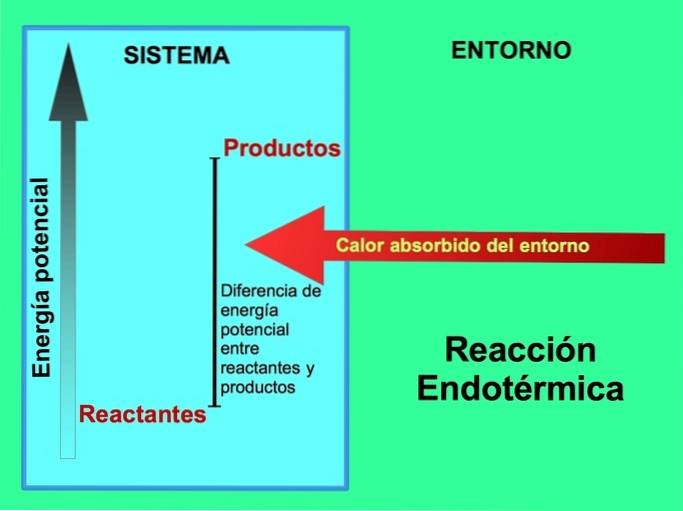
Nelle reazioni endotermiche l'energia proviene dall'ambiente esterno al sistema. La quantità di energia potenziale dei prodotti è maggiore dell'energia potenziale dei reagenti. Pertanto, è necessario aggiungere energia ai reagenti affinché la reazione proceda. Questa energia proviene dal calore dell'ambiente.
Per esempio, la fotosintesi è un processo endotermico, dove le piante catturano l'energia solare per produrre glucosio da anidride carbonica e ossigeno:

I prodotti della reazione di fotosintesi, glucosio e ossigeno, hanno una maggiore quantità di energia potenziale rispetto ai reagenti, anidride carbonica e acqua. Altri esempi di reazioni chimiche endotermiche con la quantità di energia utilizzata:

Esempi di reazione endotermica
Non è solo nel laboratorio di chimica che avvengono le reazioni. Di giorno in giorno troviamo anche situazioni in cui si verificano reazioni endotermiche.
Cucinare il cibo
Anche se potrebbe non sembrare, il processo di cottura del cibo è endotermico. Per consumare determinati alimenti, dobbiamo fornire calore.
Borsa fredda istantanea
Gli impacchi freddi usati per trattare urti o distorsioni sono riempiti d'acqua, ma quando vengono agitati o urtati, una capsula contenente nitrato di ammonio si rompe all'interno. La miscelazione del nitrato di ammonio con l'acqua è una reazione endotermica, che fa raffreddare la sacca.
Cos'è una reazione esotermica?
UN La reazione esotermica è quella in cui l'energia fluisce fuori dal sistema. Questa energia viene rilasciata sotto forma di calore, quindi posizionare un termometro nel sistema di reazione aumenta la temperatura.
La parola "esotermico" è formata da exo che significa "verso l'esterno" e thermes, che significa "calore". Le reazioni esotermiche possono verificarsi spontaneamente e, in alcuni casi, essere esplosive, come la combinazione di metalli alcalini e acqua.
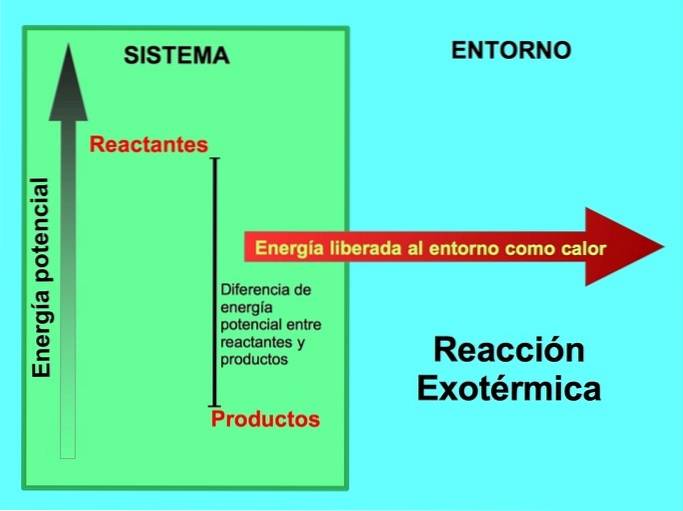
Da dove viene l'energia nelle reazioni esotermiche?
In una reazione chimica, i reagenti sono i composti che si trasformano e danno origine ai prodotti. Ad esempio, quando il sodio Na reagisce con il cloro Cl, questi sono i reagenti e il prodotto è il cloruro di sodio NaCl:
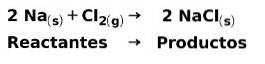
Sia i reagenti che i prodotti hanno immagazzinato energia potenziale. Sappiamo dalla lrisparmio energetico ey quell'energia non si perde né si guadagna, quindi l'energia dei reagenti deve essere uguale a quella dei prodotti.
In una reazione esotermica, li reagenti hanno più energia potenziale rispetto ai prodotti, così l'energia in eccesso viene rilasciata sotto forma di calore. In questo caso l'energia è anche considerata parte dei prodotti:

In qualsiasi processo esotermico, parte dell'energia potenziale immagazzinata nei legami chimici viene convertita in energia termica attraverso il calore..
Esempi di reazione esotermica
Detersivo per il bucato
Quando sciogliiamo un po 'di detersivo con l'acqua nelle nostre mani possiamo sentire un leggero riscaldamento.
Combustione di gas domestici
La combustione di gas per uso domestico, come metano o butano, comporta la reazione chimica con l'ossigeno con formazione di anidride carbonica e acqua e il rilascio di energia. Questa è una tipica reazione esotermica nell'uso quotidiano:
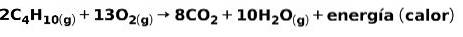
L'energia rilasciata nel processo di combustione viene utilizzata per cuocere il cibo.
Potresti anche essere interessato a sapere cosa sono sistema aperto, sistema chiuso e sistema isolato.


Nessun utente ha ancora commentato questo articolo.