
Cosa sono le triadi di Döbereiner?

Il Triadi di Döbereiner Sono gruppi di tre elementi chimici che condividono caratteristiche simili. Fanno parte dei 118 elementi chimici, essendo la diversità delle reazioni mostrate e dei loro composti, il loro aspetto più affascinante.
L'idea di classificare gli elementi è di trattare adeguatamente le loro proprietà chimiche senza la necessità di sviluppare un insieme di regole e teorie per ciascuno di essi in isolamento..
La loro classificazione periodica ha fornito un quadro sistematico immensamente utile per correlarli secondo alcuni modelli molto semplici e logici..
Gli elementi sono sistematicamente disposti in righe e colonne con numeri atomici crescenti e lo spazio è stato riservato per nuove scoperte..
Nel 1815 si conoscevano solo una trentina di oggetti. Sebbene fossero disponibili molte informazioni su questi e sui loro composti, non c'era un ordine apparente.
Furono fatti diversi tentativi per trovare l'ordine, tuttavia, era difficile organizzare tutto ciò che era noto, quindi molti scienziati iniziarono a cercare qualche modello nelle sue proprietà che permettessero di porre rimedio a questa situazione..
Scoperta delle triadi Döbereiner
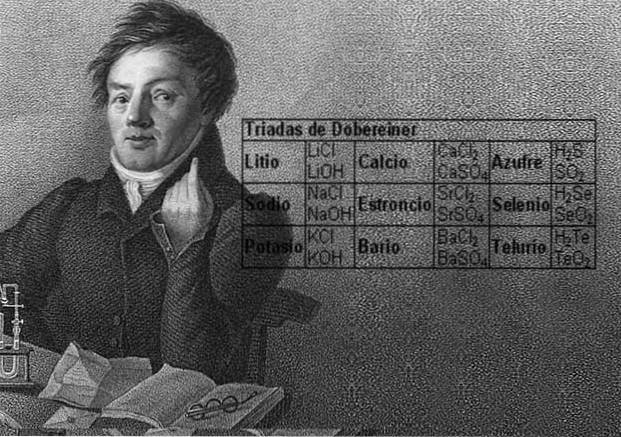
Lo scienziato Johann Wolfgang Döbereiner fece importanti scoperte sulla regolarità numerica tra i pesi atomici degli elementi, fu il primo a notare l'esistenza di diversi gruppi di tre elementi, che chiamò triadi, che mostravano somiglianze chimiche.
Questi elementi rivelavano un'importante relazione numerica, poiché una volta ordinati in base al loro peso equivalente, o peso atomico, il peso dell'elemento centrale risultava essere la media approssimativa dei due elementi rimanenti nella triade..
Nel 1817 Döbereiner scoprì che se alcuni elementi fossero combinati con l'ossigeno in composti binari, si poteva distinguere una relazione numerica tra i pesi equivalenti di questi composti.
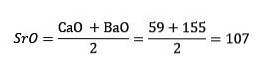
All'inizio l'osservazione di Döbereiner ebbe scarso impatto sul mondo chimico, ma in seguito divenne molto influente. Oggi è considerato uno dei pionieri nello sviluppo del sistema periodico..
Dodici anni dopo, nel 1829, Döbereiner aggiunse tre nuove triadi, che sono mostrate di seguito:
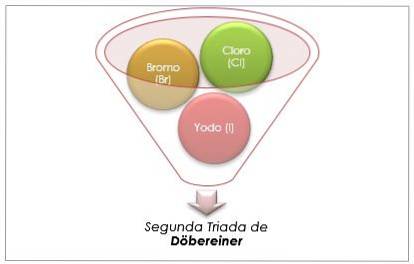
Gruppo alogeno
Il cloro, il bromo e lo iodio hanno proprietà chimiche simili e formano una triade. Questi elementi sono non metalli altamente reattivi. Se sono elencati in ordine crescente di massa relativa, sono in ordine decrescente di reattività. Il bromo ha una massa atomica intermedia tra cloro e iodio.

La massa atomica dell'elemento medio Bromo (Br) è uguale alla media delle masse atomiche di Cloro (Cl) e Iodio (I).
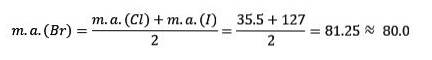
Il valore medio ottenuto è prossimo alla massa atomica del Bromo (Br).
Somiglianze nelle proprietà chimiche:
- Sono tutti non metalli.
- Tutti reagiscono con l'acqua per formare acidi (ad esempio, in: HCl, HBr, HF).
- Hanno tutti una valenza di uno (ad esempio, in: HCl, HBr, HF).
- Tutti reagiscono con metalli alcalini per formare sali neutri (ad esempio NaCl, NaBr, NaI)
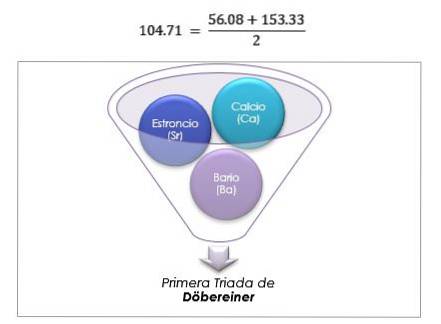
Gruppo di metalli alcalini
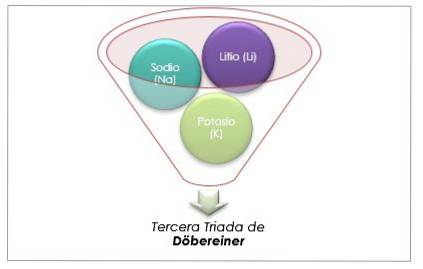
Litio, sodio e potassio hanno proprietà chimiche simili e formano una triade. Questi elementi sono metalli morbidi e leggeri ma molto reattivi..
Se sono elencati in ordine crescente di massa atomica relativa, sono anche in ordine crescente di reattività. Il sodio ha la massa atomica intermedia tra litio e potassio.

La massa atomica dell'elemento centrale Sodio (Na) è uguale alla media della massa atomica di Litio (Li) e Potassio (K).
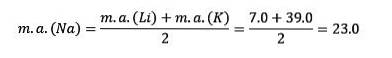
Somiglianze nelle proprietà chimiche:
- Sono tutti metalli.
- Tutti reagiscono con l'acqua per formare soluzioni alcaline e gas idrogeno..
- Hanno tutti una valenza di uno (ad esempio, in: LiCl, NaCl, KCl).
- I suoi carbonati sono resistenti alla decomposizione termica.
Gruppo di calcogeni o anfigeni
Lo zolfo, il selenio e il tellurio hanno proprietà chimiche simili e formano una triade. Il selenio ha la massa atomica intermedia tra lo zolfo e il tellurio.

La massa atomica dell'elemento intermedio Selenio (Se) è uguale alle masse atomiche medie di Zolfo (S) e Tellurio (Te).
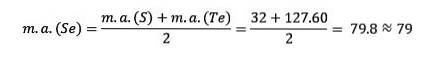
Ancora una volta il valore medio ottenuto è prossimo alla massa atomica del Selenio (Se).
Somiglianze nelle proprietà chimiche:
- Le combinazioni di idrogeno di questi elementi producono gas tossici.
- Ciascuno di questi elementi ha 6 elettroni di valenza.
- Le qualità metalliche aumentano all'aumentare del numero atomico.

Döbereiner ha anche osservato che le triadi devono rivelare relazioni chimiche tra gli elementi così come relazioni numeriche per essere valide..
D'altra parte, ha rifiutato di raggruppare il fluoro insieme a cloro, bromo e iodio, come avrebbe potuto fare per ragioni chimiche, perché non ha trovato una relazione triadica tra i pesi atomici del fluoro e quello di questi altri alogeni..
Era anche riluttante a considerare la comparsa di triadi tra elementi dissimili, come azoto, carbonio e ossigeno, nonostante mostrassero una significativa relazione numerica triadica.
Il lavoro di Dobereiner si è concentrato sulle relazioni tra gli elementi di una triade, ma non ha fornito alcun indizio sulla relazione tra le triadi..
Basti dire che la ricerca di Döbereiner ha stabilito la nozione di triadi come un concetto potente, che molti altri chimici avrebbero presto preso in considerazione..
Infatti, le triadi di Döbereiner hanno rappresentato il primo passo per raggruppare gli elementi in colonne verticali all'interno della tavola periodica e in questo modo stabilire un sistema che spiega le proprietà chimiche e rivela le relazioni fisiche degli elementi..
Estensione delle triadi
Altri chimici hanno esteso le triadi di Döbereiner per includere più dei tre elementi originali. Ad esempio, il fluoro è stato aggiunto alla parte superiore della triade contenente cloro, bromo e iodio..
Furono prodotte altre "triadi", come una contenente ossigeno, zolfo, selenio e tellurio. Ma non c'era alcun sistema che li correlasse nel loro insieme.
Uno dei principali inconvenienti era che molte masse atomiche relative erano ancora sbagliate per l'epoca..
Riferimenti
- Clugston, M. e Flemming, R. (2000), Advanced Chemistry. New York, Oxford University Press.
- Johann Wolfgang Döbereiner. Estratto da: britannica.com.
- Sauders, N. (2010). Innovazioni scientifiche e tecnologiche: chi ha inventato la tavola periodica? Minnesotta, Arcturus Publishing Limited.
- Scerri, E. (2007) La tavola periodica: la sua storia e il suo significato. New York, Oxford University Press.
- Shyamal, A. (2008), Living Science Chemistry 10. New Delhi, Ratna Sagar P. Ltd.
- Cos'è il gruppo 16 della tavola periodica? Come vengono utilizzati questi elementi? Estratto da: quora.com.



Nessun utente ha ancora commentato questo articolo.