
Unità di misura ed esperimento della legge di Avogadro
Il Legge di Avogadro postula che un uguale volume di tutti i gas, alla stessa temperatura e pressione, abbia lo stesso numero di molecole. Amadeo Avogadro, un fisico italiano, propose due ipotesi nel 1811: la prima dice che gli atomi dei gas elementari sono insieme in molecole invece di esistere come atomi separati, come disse John Dalton..
La seconda ipotesi afferma che volumi uguali di gas a pressione e temperatura costanti hanno lo stesso numero di molecole. L'ipotesi di Avogadro relativa al numero di molecole nei gas non fu accettata fino al 1858, quando il chimico italiano Stanislao Cannizaro costruì un sistema logico di chimica basato su questo.

Dalla legge di Avogadro si può dedurre quanto segue: per una data massa di un gas ideale, il suo volume e il numero di molecole sono direttamente proporzionali se la temperatura e la pressione sono costanti. Ciò implica anche che il volume molare dei gas che si comportano idealmente è lo stesso per tutti.
Ad esempio, dato un numero di palloncini, etichettati dalla A alla Z, vengono tutti riempiti fino a quando non vengono gonfiati a un volume di 5 litri. Ogni lettera corrisponde a una diversa specie gassosa; cioè le sue molecole hanno le loro caratteristiche. La legge di Avogadro afferma che tutti i palloncini ospitano lo stesso numero di molecole.
Se ora i palloncini vengono gonfiati a 10 litri, secondo le ipotesi di Avogadro, sarebbe stato introdotto il doppio del numero di moli gassose iniziali.
Indice articolo
- 1 In cosa consiste e unità di misura
- 1.1 Deduzione del valore di R quando è espresso in L atm / K mol
- 2 Forma usuale della legge di Avogadro
- 3 Conseguenze e implicazioni
- 4 origini
- 4.1 Ipotesi di Avogadro
- 4.2 Numero di Avogadro
- 5 L'esperimento di Avogadro
- 5.1 Esperimento con contenitori commerciali
- 6 esempi
- 6.1 O2 + 2H2 => 2H2O
- 6.2 N2 + 3H2 => 2NH3
- 6.3 N2 + O2 => 2NO
- 7 Riferimenti
In cosa consiste e unità di misura
La legge di Avogadro afferma che, per una massa di un gas ideale, il volume del gas e il numero di moli sono direttamente proporzionali se la temperatura e la pressione sono costanti. Matematicamente può essere espresso con la seguente equazione:
V / n = K
V = volume del gas, generalmente espresso in litri.
n = quantità della sostanza misurata in moli.
Inoltre, dalla cosiddetta legge sui gas ideali abbiamo quanto segue:
PV = nRT
P = la pressione del gas è solitamente espressa in atmosfere (atm), in mm di mercurio (mmHg) o in Pascal (Pa).
V = il volume del gas espresso in litri (L).
n = numero di moli.
T = la temperatura del gas espressa in gradi Celsius, gradi Fahrenheit o gradi Kelvin (0 ºC equivale a 273,15 K).
R = la costante universale dei gas ideali, che può essere espressa in varie unità, tra le quali spiccano le seguenti: 0,08205 L atm / K. mol (L atm K-1.Talpa-1); 8.314 J / K. mol (J.K-1.Talpa-1) (J è joule); e 1.987 cal / Kmol (cal.K-1.Talpa-1) (cal è calorie).
Deduzione del valore di R quando espresso in LAtm / KTalpa
Il volume che una mole di un gas occupa a un'atmosfera di pressione e 0 ºC equivalenti a 273K è di 22,414 litri.
R = PV / T
R = 1 atm x 22.414 (L / mol) / (273 ºK)
R = 0,082 L atm / mol.K
L'equazione del gas ideale (PV = nRT) può essere scritta come segue:
V / n = RT / P
Se si presume che la temperatura e la pressione siano costanti, poiché R è una costante, allora:
RT / P = K
Dopo:
V / n = K
Questa è una conseguenza della legge di Avogadro: l'esistenza di una relazione costante tra il volume che occupa un gas ideale e il numero di moli di quel gas, per una temperatura e una pressione costanti..
Forma usuale della legge di Avogadro
Se hai due gas, l'equazione sopra diventa la seguente:
V1/ n1= VDue/ nDue
Questa espressione è anche scritta come:
V1/ VDue= n1/ nDue
Quanto sopra mostra il rapporto di proporzionalità indicato.
Nella sua ipotesi, Avogadro ha sottolineato che due gas ideali nello stesso volume e alla stessa temperatura e pressione contengono lo stesso numero di molecole.
Per estensione, lo stesso vale per i gas reali; per esempio, un volume uguale di ODue e nDue contiene lo stesso numero di molecole quando è alla stessa temperatura e pressione.
I gas reali mostrano piccole deviazioni dal comportamento ideale. Tuttavia, la legge di Avogadro è approssimativamente valida per i gas reali a una pressione sufficientemente bassa e ad alte temperature.
Conseguenze e implicazioni
La conseguenza più significativa della legge di Avogadro è che la costante R per i gas ideali ha lo stesso valore per tutti i gas.
R = PV / nT
Quindi, se R è costante per due gas:
P1V1/ nT1= PDueVDue/ nDueTDue = costante
I suffissi 1 e 2 rappresentano due diversi gas ideali. La conclusione è che la costante del gas ideale per 1 mole di gas è indipendente dalla natura del gas. Quindi, il volume occupato da questa quantità di gas a una data temperatura e pressione sarà sempre lo stesso.
Una conseguenza dell'applicazione della legge di Avogadro è la constatazione che 1 mole di un gas occupa un volume di 22.414 litri alla pressione di 1 atmosfera e alla temperatura di 0 ºC (273K).
Un'altra ovvia conseguenza è la seguente: se pressione e temperatura sono costanti, aumentando la quantità di un gas aumenterà anche il suo volume..
origini
Nel 1811 Avogadro avanzò la sua ipotesi basata sulla teoria atomica di Dalton e sulla legge di Gay-Lussac sui vettori del moto delle molecole..
Gay-Lussac ha concluso nel 1809 che "i gas, in qualunque proporzione possano essere combinati, danno sempre origine a composti i cui elementi misurati in volume sono sempre multipli di un altro".
Lo stesso autore ha anche dimostrato che "le combinazioni di gas avvengono sempre secondo rapporti di volume molto semplici".
Avogadro ha sottolineato che le reazioni chimiche in fase gassosa coinvolgono specie molecolari sia dei reagenti che del prodotto.
Secondo questa affermazione, la relazione tra il reagente e le molecole del prodotto deve essere un numero intero, poiché non è probabile l'esistenza della rottura del legame prima della reazione (singoli atomi). Tuttavia, le quantità molari possono essere espresse con valori frazionari.
Da parte sua, la legge dei volumi di combinazione indica che anche la relazione numerica tra i volumi gassosi è semplice e intera. Ciò si traduce in un'associazione diretta tra i volumi e il numero di molecole delle specie gassose..
Ipotesi di Avogadro
Avogadro ha proposto che le molecole di gas fossero biatomiche. Questo ha spiegato come due volumi di idrogeno molecolare si combinano con un volume di ossigeno molecolare per dare due volumi di acqua..
Inoltre, Avogadro ha proposto che se volumi uguali di gas contenessero lo stesso numero di particelle, la relazione tra le densità dei gas dovrebbe essere uguale alla relazione tra le masse molecolari di queste particelle..
Ovviamente dividendo d1 per d2 si ottiene il quoziente m1 / m2, poiché il volume occupato dalle masse gassose è lo stesso per entrambe le specie e viene annullato:
d1 / d2 = (m1 / V) / (m2 / V)
d1 / d2 = m1 / m2
Il numero di Avogadro
Una talpa contiene 6.022 x 102. 3 molecole o atomi. Questa cifra si chiama numero di Avogadro, anche se non è stato lui a calcolarlo. Jean Pierre, Premio Nobel dal 1926, ha effettuato le misurazioni corrispondenti e ha suggerito il nome in onore di Avogadro.
L'esperimento di Avogadro
Una dimostrazione molto semplice della legge di Avogadro consiste nel mettere l'acido acetico in una bottiglia di vetro e poi aggiungere bicarbonato di sodio, chiudendo la bocca della bottiglia con un palloncino che impedisce l'entrata o l'uscita di un gas dall'interno della bottiglia.
L'acido acetico reagisce con il bicarbonato di sodio, rilasciando così CODue. Il gas si accumula nel pallone provocandone il gonfiaggio. Teoricamente, il volume raggiunto dal palloncino è proporzionale al numero di molecole di CODue, come stabilito dalla legge di Avogadro.
Tuttavia, questo esperimento ha una limitazione: il palloncino è un corpo elastico; quindi, poiché la sua parete si allunga per l'accumulo di CODue, in questo si genera una forza che si oppone alla sua distensione e cerca di ridurre il volume del palloncino.
Sperimenta con contenitori commerciali
Un altro esperimento illustrativo della legge di Avogadro viene presentato con l'uso di lattine di soda e bottiglie di plastica..
Nel caso delle lattine di soda, viene versato del bicarbonato di sodio e quindi viene aggiunta una soluzione di acido citrico. I composti reagiscono tra loro producendo il rilascio di gas CODue, che si accumula all'interno del barattolo.
Successivamente si aggiunge una soluzione concentrata di idrossido di sodio, che ha la funzione di "sequestrare" la CO.Due. L'accesso all'interno della lattina viene quindi rapidamente chiuso utilizzando del nastro adesivo.
Dopo un certo tempo, si osserva che la lattina si contrae, indicando che la presenza di CO è diminuita.Due. Quindi, si potrebbe pensare che ci sia una diminuzione del volume della lattina che corrisponde a una diminuzione del numero di molecole di CO.Due, secondo la legge di Avogadro.
Nell'esperimento con la bottiglia, si segue la stessa procedura della lattina di soda, e quando viene aggiunto NaOH, l'imboccatura della bottiglia viene chiusa con il coperchio; allo stesso modo si osserva una contrazione della parete della bottiglia. Di conseguenza, è possibile eseguire la stessa analisi come nel caso della lattina di soda..
Esempi
Le tre immagini sottostanti illustrano il concetto della legge di Avogadro, correlando il volume che occupano i gas e il numero di molecole di reagenti e prodotti..
ODue + 2HDue => 2HDueO
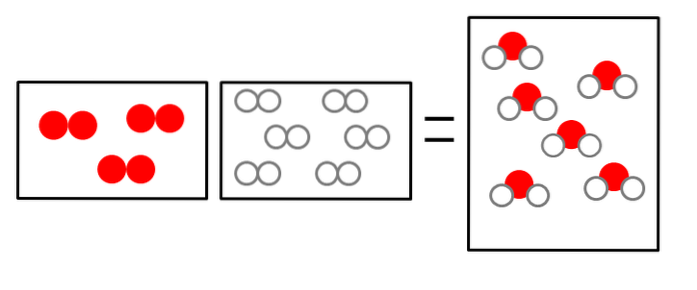
Il volume dell'idrogeno gassoso è doppio, ma occupa un contenitore delle stesse dimensioni di quello dell'ossigeno gassoso.
NDue + 3HDue => 2NH3
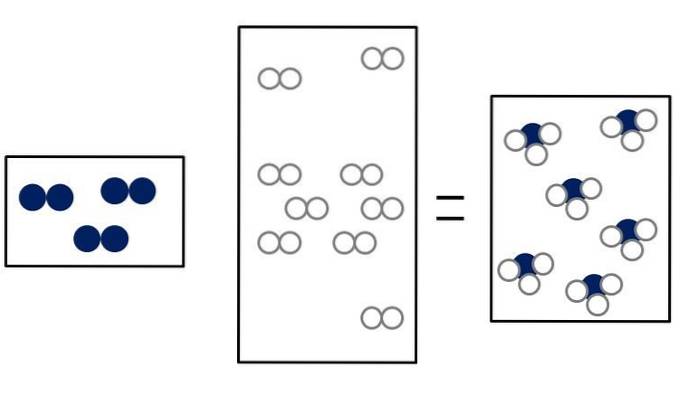
NDue + ODue => 2NO

Riferimenti
- Bernard Fernandez, PhD. (Febbraio 2009). Due ipotesi di Avogadro (1811). [PDF]. Tratto da: bibnum.education.fr
- Nuria Martínez Medina. (5 luglio 2012). Avogadro, il grande scienziato italiano dell'Ottocento. Tratto da: rtve.es
- Muñoz R. e Bertomeu Sánchez J.R. (2003) The history of science in textbooks: Avogadro's hypothesis (s), Teaching science, 21 (1), 147-161.
- Helmenstine, Anne Marie, Ph.D. (1 febbraio 2018). Qual è la legge di Avogadro? Tratto da: thoughtco.com
- The Editors of Encyclopaedia Britannica. (2016, 26 ottobre). Legge di Avogadro. Encyclopædia Britannica. Tratto da: britannica.com
- Yang, S. P. (2002). I prodotti per la casa usati per collassare i contenitori chiusi e dimostrare la legge di Avogadro. Chem Educatore. Vol: 7, pagine: 37-39.
- Glasstone, S. (1968). Trattato di Chimica Fisica. Duedà Ed. Editoriale Aguilar.


Nessun utente ha ancora commentato questo articolo.