
Cos'è la notazione spettrale?
Il notazione spettrale è la disposizione degli elettroni nei livelli di energia attorno al nucleo di un atomo. Secondo il vecchio modello atomico di Bohr, gli elettroni occupano vari livelli nelle orbite attorno al nucleo, dal primo guscio più vicino al nucleo, K, al settimo guscio, Q, che è il più lontano dal nucleo..
In termini di un modello quantistico più raffinato, i gusci K-Q sono suddivisi in un insieme di orbitali, ognuno dei quali può essere occupato da non più di una coppia di elettroni..

Comunemente, la configurazione elettronica viene utilizzata per descrivere gli orbitali di un atomo nel suo stato fondamentale, ma può anche essere utilizzata per rappresentare un atomo che si è ionizzato in un catione o anione, compensando la perdita o il guadagno di elettroni nei rispettivi orbitali ..
Molte delle proprietà fisiche e chimiche degli elementi possono essere correlate alle loro configurazioni elettroniche uniche. Gli elettroni di valenza, gli elettroni nel guscio più esterno, sono il fattore determinante per la chimica unica dell'elemento..
Quando gli elettroni nel guscio più esterno di un atomo ricevono energia di qualche tipo, si spostano verso strati di energia superiore. Pertanto, un elettrone nel guscio K verrà trasferito al guscio L in uno stato di energia superiore.
Quando l'elettrone ritorna al suo stato fondamentale, rilascia l'energia assorbita emettendo uno spettro elettromagnetico (luce). Poiché ogni atomo ha una configurazione elettronica specifica, avrà anche uno spettro specifico che sarà chiamato spettro di assorbimento (o emissione)..
Per questo motivo, il termine notazione spettrale viene utilizzato per fare riferimento alla configurazione elettronica.
Come determinare la notazione spettrale: i numeri quantistici
Un totale di quattro numeri quantici vengono utilizzati per descrivere completamente il movimento e le traiettorie di ciascun elettrone all'interno di un atomo..
La combinazione di tutti i numeri quantici di tutti gli elettroni in un atomo è descritta da una funzione d'onda che soddisfa l'equazione di Schrödinger. Ogni elettrone in un atomo ha un insieme unico di numeri quantici.
Secondo il principio di esclusione di Pauli, due elettroni non possono condividere la stessa combinazione di quattro numeri quantici.
I numeri quantici sono importanti perché possono essere usati per determinare la configurazione elettronica di un atomo e la probabile posizione degli elettroni nell'atomo..
I numeri quantici vengono utilizzati anche per determinare altre caratteristiche degli atomi, come l'energia di ionizzazione e il raggio atomico..
I numeri quantici designano gusci, subshell, orbitali e spin specifici di elettroni.
Ciò significa che descrivono completamente le caratteristiche di un elettrone in un atomo, cioè descrivono ogni soluzione unica dell'equazione di Schrödinger, o la funzione d'onda, degli elettroni in un atomo..
Ci sono un totale di quattro numeri quantici: il numero quantico principale (n), il numero quantico del momento angolare orbitale (l), il numero quantico magnetico (ml) e il numero quantico di spin dell'elettrone (ms).
Il numero quantico principale, nn, descrive l'energia di un elettrone e la distanza più probabile dell'elettrone dal nucleo. In altre parole, si riferisce alla dimensione dell'orbitale e al livello di energia a cui si trova un elettrone..
Il numero di subshell, o ll, descrive la forma dell'orbitale. Può anche essere utilizzato per determinare il numero di nodi angolari.
Il numero quantico magnetico, ml, descrive i livelli di energia in una subshell e ms si riferisce allo spin dell'elettrone, che può essere alto o basso..
Principio di Aufbau
Aufbau deriva dalla parola tedesca "Aufbauen" che significa "costruire". In sostanza, scrivendo configurazioni elettroniche stiamo costruendo orbitali elettronici mentre ci spostiamo da un atomo all'altro..
Mentre scriviamo la configurazione elettronica di un atomo, riempiremo gli orbitali in ordine crescente di numero atomico.
Il principio di Aufbau ha origine dal principio di esclusione di Pauli che dice che non ci sono due fermioni (ad esempio gli elettroni) in un atomo.
Possono avere lo stesso insieme di numeri quantici, quindi devono "impilarsi" a livelli di energia più elevati. Il modo in cui gli elettroni si accumulano è una questione di configurazioni elettroniche.
Gli atomi stabili hanno tanti elettroni quanti ne hanno i protoni nel nucleo. Gli elettroni si raccolgono attorno al nucleo negli orbitali quantistici seguendo quattro regole di base chiamate principio di Aufbau..
- Non ci sono due elettroni nell'atomo che condividono gli stessi quattro numeri quantici n, l, m e s.
- Gli elettroni occuperanno per primi gli orbitali con il livello di energia più basso.
- Gli elettroni riempiranno sempre gli orbitali con lo stesso numero di spin. Quando gli orbitali sono pieni inizierà.
- Gli elettroni riempiranno gli orbitali della somma dei numeri quantici ne l. Gli orbitali con valori uguali di (n + l) verranno riempiti per primi con i valori n inferiori.
La seconda e la quarta regola sono fondamentalmente le stesse. Un esempio della regola quattro sarebbero gli orbitali 2p e 3s.
Un orbitale 2p è n = 2 el = 2 e un orbitale 3s è n = 3 e l = 1. (N + l) = 4 in entrambi i casi, ma l'orbitale 2p ha l'energia più bassa o il valore n più basso e riempire prima dello strato 3s.
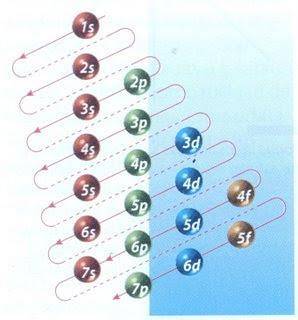
Fortunatamente, il diagramma di Moeller mostrato nella Figura 2 può essere utilizzato per eseguire il riempimento di elettroni. Il grafico viene letto eseguendo le diagonali da 1s.
La figura 2 mostra gli orbitali atomici e le frecce seguono la via da seguire.
Ora che l'ordine degli orbitali è noto per essere riempito, l'unica cosa rimasta è memorizzare la dimensione di ciascun orbitale.
Gli orbitali S hanno 1 valore possibile di ml per contenere 2 elettroni
Gli orbitali P hanno 3 possibili valori di ml per contenere 6 elettroni
Gli orbitali D hanno 5 possibili valori di ml per contenere 10 elettroni
Gli orbitali F hanno 7 possibili valori di ml per contenere 14 elettroni
Questo è tutto ciò che è necessario per determinare la configurazione elettronica di un atomo stabile di un elemento..
Ad esempio, prendi l'elemento azoto. L'azoto ha sette protoni e quindi sette elettroni. Il primo orbitale da riempire è l'orbitale 1s. Un orbitale ha due elettroni, quindi ne rimangono cinque.
L'orbitale successivo è l'orbitale 2s e contiene i due successivi. Gli ultimi tre elettroni andranno all'orbitale 2p che può contenere fino a sei elettroni.
Hund regole
La sezione di Aufbau ha discusso di come gli elettroni riempiono prima gli orbitali di energia più bassa e poi si spostano verso gli orbitali di energia più alta solo dopo che gli orbitali di energia più bassa sono stati riempiti..
Tuttavia, c'è un problema con questa regola. Certamente, gli orbitali 1s devono essere riempiti prima degli orbitali 2s, perché gli orbitali 1s hanno un valore inferiore di n, e quindi un'energia inferiore..
E i tre diversi orbitali 2p? In quale ordine devono essere riempiti? La risposta a questa domanda riguarda la regola di Hund.
La regola di Hund afferma che:
- Ogni orbitale in un sottolivello viene occupato individualmente prima che qualsiasi orbitale sia occupato doppiamente.
- Tutti gli elettroni negli orbitali occupati individualmente hanno lo stesso spin (per massimizzare lo spin totale).
Quando gli elettroni vengono assegnati agli orbitali, un elettrone cerca prima di riempire tutti gli orbitali con energia simile (chiamati anche orbitali degeneri) prima di accoppiarsi con un altro elettrone in un orbitale mezzo pieno..
Gli atomi negli stati fondamentali tendono ad avere il maggior numero possibile di elettroni spaiati. Quando visualizzi questo processo, considera come gli elettroni mostrano lo stesso comportamento degli stessi poli in un magnete se dovessero entrare in contatto..
Quando gli elettroni caricati negativamente riempiono gli orbitali, cercano innanzitutto di allontanarsi il più possibile l'uno dall'altro prima di doversi accoppiare..
Riferimenti
- Anastasiya Kamenko, T. E. (2017, 24 marzo). Numeri quantistici. Recupero da chem.libretexts.org.
- Principio di Aufbau. (2015, 3 giugno). Recupero da chem.libretexts.org.
- Configurazioni elettroniche e proprietà degli atomi. (S.F.). Recuperato da oneonta.edu.
- Encyclopædia Britannica. (2011, 7 settembre). Configurazione elettronica. Recuperato da britannica.com.
- Helmenstine, T. (2017, 7 marzo). Il principio Aufbau - Struttura elettronica e il principio Aufbau. Recuperato da thoughtco.com.
- Regole di Hund. (2015, 18 luglio). Recupero da chem.libretexts.org.
- Notazione spettroscopica. (S.F.). Recupero da bcs.whfreeman.com.



Nessun utente ha ancora commentato questo articolo.