
Cos'è la densità elettronica?
Il densità elettronica è una misura della probabilità di trovare l'elettrone in una data regione dello spazio; o attorno a un nucleo atomico, o nelle "vicinanze" all'interno di strutture molecolari.
Maggiore è la concentrazione di elettroni in un dato punto, maggiore è la densità di elettroni, e quindi, sarà distinto dall'ambiente circostante e mostrerà alcune caratteristiche che spiegano la reattività chimica. Un modo eccellente e grafico per rappresentare un tale concetto è attraverso il mappa del potenziale elettrostatico.

Ad esempio, l'immagine in alto mostra la struttura dell'enantiomero S-carnitina con la sua corrispondente mappa del potenziale elettrostatico. Si può osservare una scala composta dai colori dell'arcobaleno: rosso per indicare la regione con la più alta densità di elettroni e blu per quella regione che è povera di elettroni..
Mentre la molecola viene attraversata da sinistra a destra, ci allontaniamo dal gruppo -CODue- verso lo scheletro CHDue-CHOH-CHDue, dove i colori sono giallo e verde, indicando una diminuzione della densità elettronica; fino al gruppo -N (CH3)3+, la regione più povera di elettroni, colorata di blu.
Generalmente, le regioni in cui la densità elettronica è bassa (quelle colorate in giallo e verde) sono le meno reattive in una molecola..
Indice articolo
- 1 Concetto
- 2 Mappa del potenziale elettrostatico
- 2.1 Confronto dei colori
- 2.2 Reattività chimica
- 3 Densità elettronica nell'atomo
- 4 Riferimenti
Concetto
Più che chimica, la densità elettronica è di natura fisica, perché gli elettroni non rimangono statici, ma viaggiano da un lato all'altro creando campi elettrici..
E la variazione di questi campi causa le differenze nelle densità di elettroni nelle superfici di van der Waals (tutte quelle superfici delle sfere).
La struttura della S-carnitina è rappresentata da un modello di sfere e barre, ma se fosse dalla sua superficie van der Waals, le barre scomparirebbero e si osserverebbe solo un insieme di sfere incrostate (con gli stessi colori).
È più probabile che gli elettroni si trovino intorno agli atomi più elettronegativi; tuttavia, ci possono essere più di un atomo elettronegativo nella struttura molecolare, e quindi gruppi di atomi che esercitano anche il proprio effetto induttivo.
Ciò significa che il campo elettrico varia più di quanto si possa prevedere osservando una molecola da una vista a volo d'uccello; cioè, ci può essere più o meno polarizzazione delle cariche negative o della densità elettronica.
Questo può anche essere spiegato come segue: la distribuzione del carico diventa più omogenea.
Mappa del potenziale elettrostatico
Ad esempio, poiché il gruppo -OH ha un atomo di ossigeno, attrae la densità elettronica degli atomi vicini; tuttavia, nella S-carnitina cede parte della sua densità elettronica al gruppo -CODue-, mentre allo stesso tempo lascia il gruppo -N (CH3)3+ con maggiore carenza elettronica.
Si noti che può essere molto difficile dedurre come funzionano gli effetti induttivi in una molecola complessa, come una proteina..
Per avere una panoramica a portata di mano di tali differenze nei campi elettrici nella struttura, viene utilizzato il calcolo computazionale delle mappe del potenziale elettrostatico..
Questi calcoli consistono nel posizionare una carica puntiforme positiva e spostarla lungo la superficie della molecola; dove c'è meno densità di elettroni, ci sarà repulsione elettrostatica, e maggiore è la repulsione, più intenso sarà il colore blu.
Dove la densità elettronica è maggiore, ci sarà una forte attrazione elettrostatica, rappresentata dal colore rosso.
I calcoli tengono conto di tutti gli aspetti strutturali, i momenti di dipolo dei legami, gli effetti induttivi causati da tutti gli atomi altamente elettronegativi, ecc. E di conseguenza, ottieni quelle superfici colorate e visivamente accattivanti..
Confronto dei colori
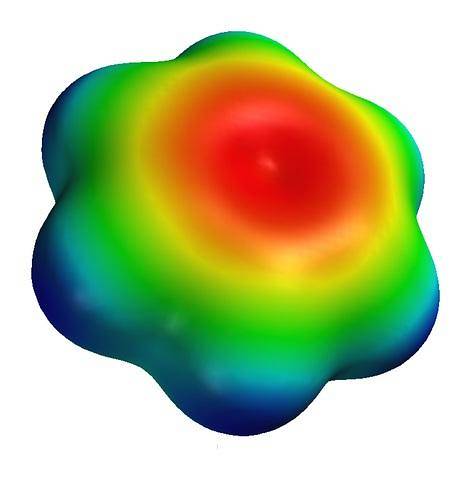
Sopra è la mappa del potenziale elettrostatico per una molecola di benzene. Si noti che al centro dell'anello c'è una densità elettronica più alta, mentre le sue "punte" sono di colore bluastro, a causa degli atomi di idrogeno meno elettronegativi. Allo stesso modo, questa distribuzione delle cariche è dovuta al carattere aromatico del benzene.
In questa mappa si osservano anche i colori verde e giallo, che indicano le approssimazioni alle regioni povere e ricche di elettroni..
Questi colori hanno una propria scala, diversa da quella della S-carnitina; e quindi non è corretto confrontare il gruppo -CODue- e il centro dell'anello aromatico, entrambi rappresentati dal colore rosso sulle loro mappe.
Se entrambi mantenessero la stessa scala di colori, il colore rosso sulla mappa del benzene si vedrebbe diventare di un debole arancione. In base a questa standardizzazione, è possibile confrontare le mappe del potenziale elettrostatico e quindi le densità di elettroni di varie molecole..
Altrimenti, la mappa servirebbe solo a conoscere le distribuzioni di carica per una singola molecola..
Reattività chimica
Osservando una mappa del potenziale elettrostatico, e quindi delle regioni con densità di elettroni alta e bassa, è possibile prevedere (sebbene non in tutti i casi) dove si verificheranno reazioni chimiche nella struttura molecolare..
Le regioni con un'elevata densità elettronica sono in grado di "fornire" i propri elettroni alle specie circostanti che ne hanno bisogno o che ne hanno bisogno; a queste specie, caricate negativamente, E+, sono conosciuti come elettrofili.
Pertanto, gli elettrofili possono reagire con i gruppi rappresentati dal colore rosso (il -CODue- e il centro dell'anello benzenico).
Mentre le regioni a bassa densità elettronica, reagiscono con specie caricate negativamente, o con quelle che hanno coppie libere di elettroni da condividere; questi ultimi sono noti come nucleofili.
Nel caso di -N (CH3)3+, reagirà in modo tale che l'atomo di azoto guadagni elettroni (si riduca).
Densità elettronica nell'atomo
Nell'atomo gli elettroni si muovono a velocità enormi e possono trovarsi in più regioni dello spazio contemporaneamente.
Tuttavia, all'aumentare della distanza dal nucleo, gli elettroni acquisiscono energia potenziale elettronica e la loro distribuzione probabilistica diminuisce..
Ciò significa che le nuvole elettroniche di un atomo non hanno un bordo definito, ma uno sfocato. Pertanto, non è facile calcolare il raggio atomico; A meno che non ci siano vicini che stabiliscono una differenza nelle distanze dei loro nuclei, metà delle quali può essere presa come raggio atomico (r = d / 2).
Gli orbitali atomici e le loro funzioni d'onda radiale e angolare dimostrano come la densità elettronica cambia in funzione della distanza che li separa dal nucleo..
Riferimenti
- Reed College. (s.f.). Cos'è la densità elettronica? ROCO. Estratto da: reed.edu
- Wikipedia. (2018). Densità elettronica. Estratto da: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (11 giugno 2014). Definizione di densità elettronica. Estratto da: thoughtco.com
- Steven A. Hardinger. (2017). Glossario illustrato di chimica organica: densità elettronica. Estratto da: chem.ucla.edu
- Chemistry LibreTexts. (29 novembre 2018). Dimensioni atomiche e distribuzioni della densità elettronica. Recupero da: chem.libretexts.org
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimica organica. Ammine. (10th edizione.). Wiley plus.
- Carey F. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.



Nessun utente ha ancora commentato questo articolo.