
Struttura, caratteristiche, esempi delle molecole anfipatiche
Il molecole anfipatiche o anfifiliche Sono quelli che possono provare affinità o repulsione allo stesso tempo per un certo solvente. I solventi sono classificati chimicamente come polari o apolari; idrofilo o idrofobo. Quindi, questi tipi di molecole possono "amare" l'acqua, così come possono anche "odiarla"..
Secondo la definizione precedente, c'è un solo modo perché ciò sia possibile: queste molecole devono avere regioni polari e apolari all'interno delle loro strutture; O sono distribuiti in modo più o meno omogeneo (come nel caso delle proteine, ad esempio), oppure sono localizzati in modo eterogeneo (nel caso dei tensioattivi)

I tensioattivi, chiamati anche detergenti, sono forse le molecole anfipatiche più conosciute da tempo immemorabile. Da quando l'Uomo è rimasto affascinato dalla strana fisionomia di una bolla, preoccupato per la preparazione di saponi e prodotti per la pulizia, si è imbattuto più volte nel fenomeno della tensione superficiale.
Osservare una bolla è come assistere a una “trappola” le cui pareti, formate dall'allineamento di molecole anfipatiche, trattengono il contenuto gassoso dell'aria. Le sue forme sferiche sono le più matematicamente e geometricamente stabili, poiché riducono al minimo la tensione superficiale dell'interfaccia aria-acqua..
Detto questo, sono state discusse altre due caratteristiche delle molecole anfipatiche: tendono ad associarsi o autoassemblarsi e alcune tensioni superficiali inferiori nei liquidi (quelle che possono farlo sono chiamate tensioattivi).
Per effetto dell'elevata tendenza ad associarsi, queste molecole aprono un campo di studio morfologico (e anche architettonico) dei loro nanoaggregati e delle supramolecole che le compongono; con l'obiettivo di progettare composti funzionalizzabili e interagire in modi incommensurabili con le cellule e le loro matrici biochimiche.
Indice articolo
- 1 Struttura
- 1.1 Interazioni intermolecolari
- 1.2 Varie
- 2 Caratteristiche delle molecole anfipatiche
- 2.1 Associazione
- 2.2 Fisico
- 3 esempi
- 4 Applicazioni
- 4.1 Membrane cellulari
- 4.2 Disperdenti
- 4.3 Emulsionanti
- 4.4 Detergenti
- 4.5 Antiossidanti
- 5 Riferimenti
Struttura
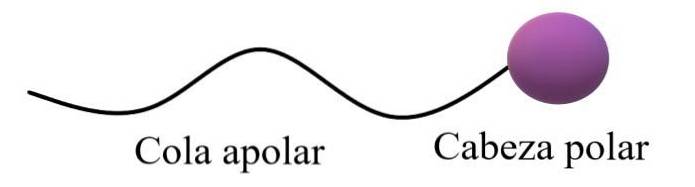
Si diceva che le molecole anfifiliche o anfipatiche avessero una regione polare e una regione apolare. La regione apolare è solitamente costituita da una catena di carbonio saturo o insaturo (con doppi o tripli legami), che è rappresentata come una "coda apolare"; accompagnato da una “testa polare”, in cui risiedono gli atomi più elettronegativi.
La struttura generale superiore illustra i commenti nel paragrafo precedente. La testa polare (sfera viola) può essere gruppi funzionali o anelli aromatici che hanno momenti di dipolo permanenti e sono anche in grado di formare legami idrogeno. Pertanto, il più alto contenuto di ossigeno e azoto dovrebbe essere situato lì.
In questa testa polare possono esserci anche cariche ioniche, negative o positive (o entrambe allo stesso tempo). Questa regione è quella che mostra un'elevata affinità per l'acqua e altri solventi polari..
D'altra parte, la coda apolare, dati i suoi legami C-H predominanti, interagisce attraverso le forze di dispersione di Londra. Questa regione è responsabile del fatto che le molecole anfipatiche mostrano anche affinità per i grassi e le molecole apolari nell'aria (NDue, CODue, Ar, ecc.).
In alcuni testi di chimica il modello per la struttura superiore è paragonato alla forma di un lecca-lecca.
Interazioni intermolecolari
Quando una molecola anfipatica entra in contatto con un solvente polare, ad esempio l'acqua, le sue regioni esercitano effetti diversi sulle molecole di solvente..
Per cominciare, le molecole d'acqua cercano di solvatare o idratare la testa polare, rimanendo lontane dalla coda apolare. In questo processo si crea un disordine molecolare.
Nel frattempo, le molecole d'acqua attorno alla coda apolare tendono a disporsi come se fossero piccoli cristalli, consentendo loro di ridurre al minimo le repulsioni. In questo processo viene creato un ordine molecolare.
Tra disturbi e ordini, arriverà un punto in cui la molecola anfipatica cercherà di interagire con un'altra, il che si tradurrà in un processo molto più stabile.
Miscelas
Entrambi saranno avvicinati attraverso le loro code apolari o teste polari, in modo tale che le regioni correlate interagiscano per prime. È come immaginare che due "lecca lecca viola" nell'immagine sopra, si avvicinino intrecciando le loro code nere o unendo le loro due teste viola..
E inizia così un interessante fenomeno di associazione, in cui molte di queste molecole si uniscono consecutivamente. Non vengono associati arbitrariamente, ma secondo una serie di parametri strutturali, che finiscono per isolare le code apolari in una sorta di “nucleo apolare”, esponendo le teste polari come un guscio polare..
Si dice quindi che sia nata una miscella sferica. Tuttavia, durante la formazione della miscela c'è una fase preliminare costituita dal cosiddetto doppio strato lipidico. Queste e altre sono alcune delle tante macrostrutture che le molecole anfifiliche possono adottare.
Caratteristiche delle molecole anfipatiche
Associazione

Se le code apolari sono prese come unità nere e le teste polari come unità viola, si capirà perché nell'immagine superiore la corteccia della miscela è viola e il suo nucleo è nero. Il nucleo è apolare e le sue interazioni con l'acqua o le molecole di solvente sono zero..
Se invece il solvente o mezzo è apolare, saranno le teste polari a subire le repulsioni, e di conseguenza si troveranno al centro della miscella; cioè è invertito (A, immagine in basso).
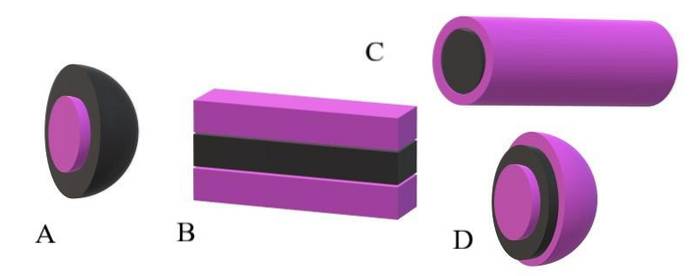
Si osserva che la miscela invertita ha un guscio apolare nero e un nucleo polare viola. Ma, prima che si formino le miscele, le molecole anfifiliche si trovano alterando individualmente l'ordine delle molecole di solvente. Maggiore concentrazione, iniziano ad associarsi in una struttura di uno o due strati (B).
Da B le lamine iniziano a curvarsi per formare D, una vescicola. Un'altra possibilità, a seconda della forma della coda apolare rispetto alla sua testa polare, è che si associno per dare origine a una miscella cilindrica (C).
Nanoaggregati e supramolecole
Ci sono quindi cinque strutture principali, che rivelano una caratteristica fondamentale di queste molecole: la loro elevata tendenza ad associarsi e autoassemblarsi in supramolecole, che si aggregano per formare nanoaggregati..
Pertanto, le molecole anfifiliche non si trovano da sole ma in associazione..
Fisico
Le molecole anfipatiche possono essere neutre o caricate ionicamente. Quelli che hanno cariche negative hanno un atomo di ossigeno con una carica formale negativa nella loro testa polare. Alcuni di questi atomi di ossigeno provengono da gruppi funzionali come: -COO-, -SW4-, -SW3- o -PO4-.
Per quanto riguarda le cariche positive, generalmente provengono da ammine, RNH3+.
La presenza o l'assenza di queste cariche non cambia il fatto che queste molecole generalmente formano solidi cristallini; oppure, se sono relativamente leggeri, si trovano come oli.
Esempi
Di seguito verranno menzionati alcuni esempi di molecole anfipatiche o anfifiliche:
-Fofolipidi: fosfatidiletanolamina, sfingomielina, fosfatidilserina, fosfatidilcolina.
-Colesterolo.
-Glicolipidi.
-Sodio lauril solfato.
-Proteine (sono anfifiliche, ma non tensioattive).
-Grassi fenolici: cardanolo, cardoli e acidi anacardici.
-Bromuro di cetiltrimetilammonio.
-Acidi grassi: palmitico, linoleico, oleico, laurico, stearico.
-Alcoli a catena lunga: 1-dodecanolo e altri.
-Polimeri anfifilici: come le resine fenoliche etossilate.
Applicazioni
Membrane cellulari
Una delle conseguenze più importanti della capacità di queste molecole di associarsi è che costruiscono una sorta di muro: il doppio strato lipidico (B).
Questo doppio strato si estende per proteggere e regolare l'entrata e l'uscita dei composti nelle cellule. È dinamico, poiché le sue code apolari ruotano aiutando le molecole anfipatiche a muoversi..
Allo stesso modo, quando questa membrana è attaccata a due estremità, per averla verticalmente, viene utilizzata per misurarne la permeabilità; e con ciò si ottengono dati preziosi per la progettazione di materiali biologici e membrane sintetiche dalla sintesi di nuove molecole anfipatiche con differenti parametri strutturali..
Disperdenti
Nell'industria petrolifera, queste molecole e i polimeri da esse sintetizzati vengono utilizzati per disperdere gli asfalteni. Il focus di questa applicazione si basa sull'ipotesi che gli asfalteni siano costituiti da un solido colloidale, con un'elevata tendenza a flocculare e sedimentare come un solido bruno-nero che causa gravi problemi economici..
Le molecole anfipatiche aiutano a mantenere gli asfalteni dispersi più a lungo di fronte ai cambiamenti fisico-chimici del grezzo..
Emulsionanti
Queste molecole aiutano a mescolare due liquidi che non sarebbero miscibili in condizioni normali. Nei gelati, ad esempio, aiutano l'acqua e l'aria a formare parte dello stesso solido insieme al grasso. Tra gli emulsionanti più utilizzati per questo scopo ci sono quelli derivati da acidi grassi commestibili.
Detersivi
Il carattere anfifilico di queste molecole viene utilizzato per intrappolare grassi o impurità apolari, per poi essere portati via contemporaneamente da un solvente polare, come l'acqua..
Come l'esempio delle bolle in cui è stata intrappolata l'aria, i detergenti intrappolano il grasso all'interno delle loro micelle che, avendo un guscio polare, interagiscono in modo efficiente con l'acqua per rimuovere lo sporco..
Antiossidanti
Le teste polari sono di vitale importanza in quanto definiscono i molteplici usi che queste molecole possono avere all'interno del corpo.
Se hanno, ad esempio, una serie di anelli aromatici (compresi i derivati di un anello fenolico) e anelli polari in grado di neutralizzare i radicali liberi, allora ci saranno antiossidanti anfifili; e se mancano anche di effetti tossici, ci saranno nuovi antiossidanti disponibili sul mercato.
Riferimenti
- Alberts B, Johnson A, Lewis J, et al. (2002). Biologia molecolare della cellula. 4a edizione. New York: Garland Science; Il lipid bilayer. Estratto da: ncbi.nlm.nih.gov
- Jianhua Zhang. (2014). Molecole anfifiliche. Springer-Verlag Berlin Heidelberg, E. Droli, L. Giorno (a cura di), Encyclopedia of Membranes, DOI 10.1007 / 978-3-642-40872-4_1789-1.
- Disse Joseph. (2019). Definizione di molecole anfipatiche. Studia. Estratto da: study.com
- Lehninger, A. L. (1975). Biochimica. (2a edizione). Worth Publishers, inc.
- Mathews, C. K., van Holde, K. E. e Ahern, K. G. (2002). Biochimica. (3a edizione). Pearson Addison Weshley.
- Helmenstine, Anne Marie, Ph.D. (31 marzo 2019). Cos'è un tensioattivo? Estratto da: thoughtco.com
- Domenico Lombardo, Mikhail A. Kiselev, Salvatore Magazù e Pietro Calandra (2015). Autoassemblaggio degli anfifili: concetti di base e prospettive future degli approcci supramolecolari. Advances in Condensed Matter Physics, vol. 2015, ID articolo 151683, 22 pagine, 2015. doi.org/10.1155/2015/151683.
- Anankanbil S., Pérez B., Fernandes I., Magdalena K. Widzisz, Wang Z., Mateus N. e Guo Z. (2018). Un nuovo gruppo di molecole anfifiliche sintetiche contenenti fenolico per applicazioni polivalenti: caratterizzazione fisico-chimica e studio della tossicità cellulare. Rapporto scientifico volume 8, numero articolo: 832.



Nessun utente ha ancora commentato questo articolo.