
Struttura chimica, proprietà e usi del propilene

Il propilene oppure propene a temperatura ambiente e pressione atmosferica è allo stato gassoso e, come altri alcheni, è incolore. Ha un odore simile all'olio ma meno intenso. Presenta un momento di dipolo poiché, sebbene manchi di un forte legame polare, la sua molecola è asimmetrica.
Allo stesso modo, il propilene è un isomero strutturale del ciclopropano (hanno la stessa formula chimica C3H6). Si manifesta in natura come conseguenza dei processi di vegetazione e fermentazione. Viene prodotto artificialmente durante la lavorazione di combustibili fossili come petrolio, gas naturale e, in misura minore, carbonio.

Allo stesso modo, l'etilene e il propilene sono prodotti della raffinazione del petrolio in un processo di scissione di grandi molecole di idrocarburi per generare piccoli idrocarburi molto richiesti..
Il propilene può anche essere ottenuto utilizzando diverse metodologie:
- Reagendo in modo reversibile etilene e butene, dove i doppi legami vengono rotti e riformulati per dare propilene.
- Attraverso un processo di deidrogenazione (perdita di idrogeno) del propano.
- Nell'ambito di un programma per la produzione di olefine dal metanolo (MTO), il propilene è stato prodotto dal metanolo. Questa è stata fatta passare attraverso il catalizzatore della zeolite, che ne favorisce la disidratazione e porta alla formazione di etilene e propilene..
3CH3OH (metanolo) => CH3CH = CHDue (propilene) + 3HDueO (acqua)
Indice articolo
- 1 Struttura chimica
- 2 Proprietà
- 2.1 Peso molecolare
- 2.2 Punto di ebollizione
- 2.3 Punto di fusione
- 2.4 Punto di infiammabilità
- 2.5 Solubilità
- 2.6 Solubilità espressa come massa
- 2.7 Densità
- 2.8 Densità del vapore
- 2.9 Pressione di vapore
- 2.10 Autoaccensione
- 2.11 Viscosità
- 2.12 Calore di combustione
- 2.13 Calore di vaporizzazione
- 2.14 Tensione superficiale
- 2.15 Polimerizzazione
- 2.16 Punto di congelamento
- 2.17 Soglia di odore
- 3 usi
- 3.1 Polipropilene
- 3.2 Acrilonitrile
- 3.3 Ossido di propilene
- 3.4 Per la sintesi di alcoli e altri usi
- 4 Riferimenti
Struttura chimica
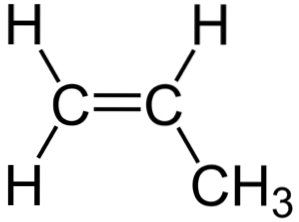
Nell'immagine in alto si può vedere la struttura chimica del propilene, in cui risalta la sua asimmetria (il lato destro è diverso da quello sinistro). Il suo scheletro di carbonio, esclusi gli atomi di H, può essere visto come un boomerang.
Questo boomerang ha un'insaturazione o un doppio legame su uno dei suoi lati (il C.1) e quindi è piatto a causa dell'ibridazione spDue di atomi di carbonio.
Tuttavia, l'altro lato è occupato dal gruppo metile (-CH3), la cui ibridazione è sp3 e ha una geometria tetraedrica. Quindi, visto di fronte, il boomerang è piatto con gli atomi di H che sporgono da esso a circa 109,5 °.
Nella fase gassosa, la molecola interagisce debolmente con le altre mediante forze di dispersione. Allo stesso modo, le interazioni tra i doppi legami (π-π) di due molecole di propilene sono prevenute dal gruppo metile.
Ciò si traduce in una diminuzione delle sue forze intermolecolari, che si riflette nelle sue proprietà fisiche. Solo a temperature molto basse, il propilene può adottare una struttura solida, in cui i boomerang rimangono raggruppati con le loro deboli interazioni.
Proprietà
È un gas incolore con un odore aromatico. Viene trasportato sotto forma di gas liquefatto e, quando fuoriesce dai contenitori che lo contengono, lo fa sotto forma di gas o liquido. A basse concentrazioni forma una miscela esplosiva e infiammabile con l'aria, la densità del propilene è maggiore di quella dell'aria..
Peso molecolare
42,081 g / mol
Punto di ebollizione
53,9ºF a 760 mmHg
Da 48 ºC a 760 mmHg
Punto di fusione
301,4 ºF
185 ºC
punto d'infiammabilità
162ºF
Solubilità
44,6 ml / 100 ml in acqua.
1.250 ml / 100 ml in etanolo.
524,5 ml / 100 ml in acido acetico.
Solubilità espressa come massa
200 mg / l 25 ºC
Densità
0,609 mg / ml a -52,6º F
0,5139 a 20 ° C
Densità del vapore
1,46 a 32ºF (relativo all'aria presa come riferimento).
1,49 (aria = 1).
1,91 kg / m3 a 273,15 ºK
Pressione del vapore
1 mmHg a -205,4ºF
760 mmHg a -53,9ºF
8,69 × 103 mmHg a 25 ºC (valore estrapolato).
1.158 kPa a 25 ºC
15,4 atm a 37 ºC
Autoaccensione
851ºF
455 ºC
Viscosità
83,4 micropoise a 16,7 ºC.
Calore di combustione
16.692 BTU / libbra
10.940 cal / g
Calore di vaporizzazione
104,62 cal / g (al punto di ebollizione)
Tensione superficiale
16,7 dine / cm a 90 ° C
Polimerizzazione
Polimerizza ad alte temperature e pressioni elevate in presenza di catalizzatori.
Punto di congelamento
185,25 ° C.
Soglia di odore
10-50 mg / m3 (rilevamento)
100 mg / m3 (riconoscimento)
Applicazioni
È utilizzato nell'industria petrolchimica come combustibile e agente alchilante. Nell'industria chimica viene utilizzato come materia prima per la produzione e sintesi di numerosi derivati.
È utile principalmente nella produzione di polipropilene, acrilonitrile (ACN), ossido di propilene (PO), alcoli, cumene e acidi acrilici.
Polipropilene
Il polipropilene è uno dei principali materiali plastici utilizzati nell'elettronica e negli accessori elettrici, articoli per la casa, tappi di bottiglia e valigie..
Il materiale laminato viene utilizzato nel confezionamento di caramelle, etichette, compact disc, ecc., Mentre le fibre vengono utilizzate per realizzare cartelle e vestiti..
Acrilonitrile
I polimeri e le fibre elastomeriche sono ottenuti dall'acrilonitrile. Queste fibre vengono utilizzate per la produzione di diverse forme di abbigliamento, come maglioni, calze e abbigliamento sportivo. Sono utilizzati anche nell'arredamento della casa, cartelle, tappezzeria, cuscini e coperte..
OSSIDO di propilene
L'ossido di propilene partecipa come componente alla sintesi del poliuretano. Questo è utilizzato nella produzione di schiuma flessibile e schiuma rigida. La schiuma flessibile viene utilizzata come riempitivo nei mobili per la casa e nell'industria automobilistica.
D'altra parte, la schiuma rigida viene utilizzata principalmente come materiale isolante per l'edilizia..
Inoltre, l'ossido di propilene viene utilizzato nella produzione di glicole propilenico. Questo composto è utilizzato nella produzione di resine poliestere insature e come antigelo..
Inoltre, l'ossido di propilene viene utilizzato nella produzione di etere di glicole propilenico. Questo etere trova applicazione nella produzione di vernici, vestiti, inchiostri, resine e detergenti.
Per la sintesi di alcol e altri usi
Il propilene consente l'ottenimento di alcuni alcoli, tra cui l'isopropanolo, utilizzato come solvente nei cosmetici e nei prodotti per la cura della persona. Inoltre, svolge la funzione di agente antisettico.
- L'isopropanolo è coinvolto nella produzione di vernici, resine, inchiostri e nastri adesivi. Viene utilizzato anche nell'industria farmaceutica.
- Oxo-alcohol2-ethylhexanol è utilizzato nella produzione di ftalato, plastificanti, materiali adesivi e vernici.
- Il butanolo è utilizzato nella produzione di vernici, rivestimenti, resine, coloranti, prodotti farmaceutici e polimeri.
D'altra parte, il cumene è prodotto dalla combinazione di propilene e benzene. Il cumene è il composto principale nella produzione di fenolo e acetone, utilizzato in una varietà di prodotti, come policarbonati, resine fenoliche, resine epossidiche e metilmetacrilato..
Infine, l'acido acrilico - un altro prodotto derivato dal propilene - viene utilizzato nella produzione di esteri acrilici e resine per vernici, rivestimenti e applicazioni adesive..
Riferimenti
- Michal Osmenda. (26 dicembre 2007). Accendi il mio fuoco. [Figura]. Estratto il 23 maggio 2018 da: commons.wikimedia.org
- Il gruppo Linde. (2018). Propilene. Estratto il 23 maggio 2018 da: linde-gas.com
- Wikipedia. (2018). Propene. Estratto il 23 maggio 2018 da: en.wikipedia.org
- PubChem. (2018). Propilene. Estratto il 27 maggio 2018 da: pubchem.ncbi.nlm.nih.gov
- Vesovic Velisa. (7 febbraio 2011). Propilene. Estratto il 27 maggio 2018 da: thermopedia.com
- Jeffrey S. Plotkin. (2016, 8 agosto). Il dilemma del propilene. Estratto il 27 maggio 2018 da: acs.org
- ICIS. (6 novembre 2017). Usi del propilene e dati di mercato. Estratto il 27 maggio 2018 da: icis.com

Nessun utente ha ancora commentato questo articolo.