
Principio di Aufbau concetto e spiegazione, esempi
Il Principio di Aufbau Consiste in una guida utile per prevedere teoricamente la configurazione elettronica di un elemento. La parola aufbau si riferisce al verbo tedesco "costruire". Le regole dettate da questo principio hanno lo scopo di "aiutare a costruire l'atomo".
Quando si parla dell'ipotetica costruzione atomica, ci si riferisce esclusivamente agli elettroni, che a loro volta vanno di pari passo con il crescente numero di protoni. I protoni definiscono il numero atomico Z di un elemento chimico e per ognuno di essi aggiunto al nucleo viene aggiunto un elettrone per compensare questo aumento di carica positiva..
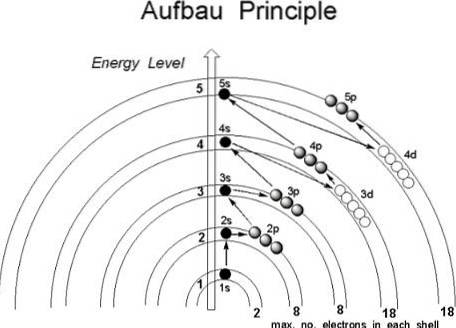
Sebbene sembri che i protoni non seguano un ordine stabilito per unirsi al nucleo dell'atomo, gli elettroni seguono una serie di condizioni, in modo tale da occupare prima le regioni dell'atomo con energia inferiore, in particolare quelle in cui il la probabilità di trovarli nello spazio è maggiore: gli orbitali.
Il principio di Aufbau, insieme ad altre regole di riempimento elettronico (il principio di esclusione di Pauli e la regola di Hund), aiuta a stabilire l'ordine in cui gli elettroni dovrebbero essere aggiunti alla nuvola di elettroni; in questo modo è possibile assegnare una corretta configurazione elettronica di un determinato elemento chimico.
Indice articolo
- 1 Concetto e spiegazione
- 1.1 Strati e sottolivelli
- 1.2 Il principio di esclusione di Pauli e la regola di Hund
- 2 esempi
- 2.1 Carbonio
- 2.2 Ossigeno
- 2.3 Calcio
- 3 Limitazioni del principio Aufbau
- 4 Riferimenti
Concetto e spiegazione
Se l'atomo fosse considerato come se fosse una cipolla, si troverebbe al suo interno un numero finito di strati, determinato dal numero quantico principale n.
Inoltre, al loro interno, ci sono le subshell, le cui forme dipendono dai numeri quantici azimutali le magnetici m.
Gli orbitali sono identificati dai primi tre numeri quantici, mentre il quarto, lo spin s, finisce per indicare in quale orbitale si troverà l'elettrone. È quindi in queste regioni dell'atomo che ruotano gli elettroni, dagli strati più interni a quelli più esterni: lo strato di valenza, il più energetico di tutti..
Stando così le cose, in quale ordine gli elettroni dovrebbero riempire gli orbitali? Secondo il principio Aufbau, dovrebbero essere assegnati in base al valore crescente (n + l).
Allo stesso modo, all'interno delle subshell (n + l) gli elettroni devono occupare la subshell con il valore di energia più basso; in altre parole, occupano il valore più basso di n.
Seguendo queste regole di costruzione, Madelung ha sviluppato un metodo visivo che consiste nel disegnare frecce diagonali, che aiutano a costruire la configurazione elettronica di un atomo. In alcuni ambiti educativi questo metodo è noto anche come metodo della pioggia..
Strati e sottolivelli
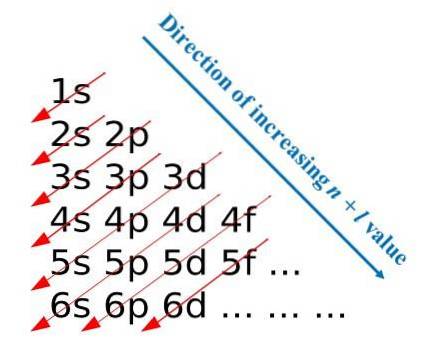
La prima immagine illustra un metodo grafico per ottenere le configurazioni elettroniche, mentre la seconda immagine è il rispettivo metodo Madelung. Gli strati più energetici si trovano nella parte superiore e i meno energetici sono in una direzione verso il basso..
Da sinistra a destra vengono “transitati” i sottostrati s, p, d e f dei corrispondenti livelli energetici principali. Come calcolare il valore di (n + l) per ogni passaggio contrassegnato dalle frecce diagonali? Ad esempio, per l'orbitale 1s questo calcolo è uguale a (1 + 0 = 1), per l'orbitale 2s (2 + 0 = 2) e per l'orbitale 3p (3 + 1 = 4).
Il risultato di questi calcoli dà origine alla costruzione dell'immagine. Pertanto, se non è disponibile a portata di mano, è sufficiente determinare (n + l) per ogni orbitale, iniziando a riempire gli orbitali di elettroni da quello con il valore più basso di (n + l) a quello con il valore massimo.
Tuttavia, l'utilizzo del metodo Madelung facilita notevolmente la costruzione della configurazione elettronica e lo rende un'attività divertente per coloro che stanno imparando la tavola periodica..
Il principio di esclusione di Pauli e la regola di Hund
Il metodo Madelung non indica gli orbitali delle subshell. Prendendoli in considerazione, il principio di esclusione di Pauli afferma che nessun elettrone può avere gli stessi numeri quantici di un altro; o qual è la stessa cosa, una coppia di elettroni non può avere spin sia positivi che negativi.
Ciò significa che i loro numeri quantici di spin s non possono essere uguali e, quindi, i loro giri devono accoppiarsi quando occupano lo stesso orbitale.
D'altra parte, il riempimento degli orbitali deve essere fatto in modo tale che siano degenerati in energia (regola di Hund). Ciò si ottiene mantenendo spaiati tutti gli elettroni negli orbitali, fino a quando non è strettamente necessario accoppiarne un paio (come con l'ossigeno).
Esempi
I seguenti esempi riassumono l'intero concetto del principio Aufbau..
Carbonio
Per determinare la sua configurazione elettronica, è necessario prima conoscere il numero atomico Z e quindi il numero di elettroni. Il carbonio ha Z = 6, quindi i suoi 6 elettroni devono essere localizzati negli orbitali usando il metodo Madelung:

Le frecce corrispondono agli elettroni. Dopo aver riempito gli orbitali 1s e 2s, ciascuno con due elettroni, agli orbitali 2p per differenza vengono assegnati i restanti due elettroni. La regola di Hund si manifesta così: due orbitali degeneri e uno vuoto.
Ossigeno

L'ossigeno ha Z = 8, quindi ha due elettroni in più a differenza del carbonio. Uno di questi elettroni deve essere posizionato nell'orbitale 2p vuoto e l'altro deve accoppiarsi per formare la prima coppia, con la freccia rivolta verso il basso. Di conseguenza, qui si manifesta il principio di esclusione di Pauli.
Calcio
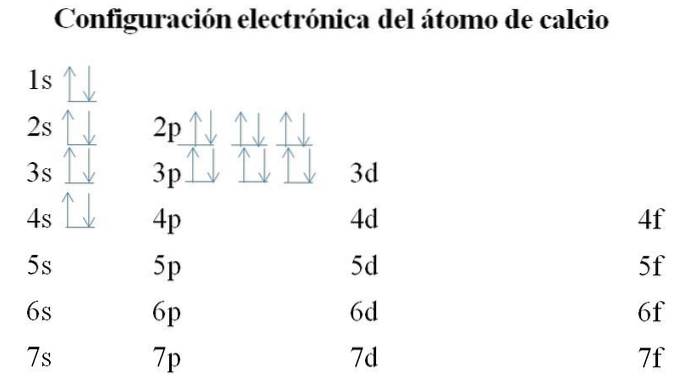
Il calcio ha 20 elettroni e gli orbitali vengono ancora riempiti con lo stesso metodo. L'ordine di riempimento è il seguente: 1s-2s-2p-3s-3p-4s.
Si può notare che invece di riempire prima l'orbitale 3d, gli elettroni occupano i 4s. Ciò si verifica prima di lasciare il posto ai metalli di transizione, elementi che riempiono lo strato interno 3d.
Limitazioni del principio Aufbau
Il principio di Aufbau non riesce a prevedere le configurazioni elettroniche di molti metalli di transizione ed elementi di terre rare (lantanidi e attinidi).
Questo perché le differenze energetiche tra gli orbitali ns e (n-1) d sono basse. Per ragioni supportate dalla meccanica quantistica, gli elettroni potrebbero preferire la degenerazione degli orbitali (n-1) d al costo di annullare o rimuovere elettroni dall'orbitale ns.
Un famoso esempio è il caso del rame. La sua configurazione elettronica prevista dal principio di Aufbau è 1sDue2sDue2 P63sDue3p64sDue3d9, quando sperimentalmente è stato dimostrato che è 1sDue2sDue2 P63sDue3p64s13d10.
Nel primo, un elettrone solitario è spaiato in un orbitale 3d, mentre nel secondo tutti gli elettroni negli orbitali 3d sono accoppiati..
Riferimenti
- Helmenstine, Anne Marie, Ph.D. (15 giugno 2017). Definizione del principio di Aufbau. Tratto da: thoughtco.com
- Prof. N. De Leon. (2001). Il principio Aufbau. Tratto da: iun.edu
- Chimica 301. Principio di Aufbau. Tratto da: ch301.cm.utexas.edu
- Hozefa Arsiwala e teacherlookup.com. (1 giugno 2017). In profondità: principio di Aufbau con esempi. Tratto da: teacherlookup.com
- Whitten, Davis, Peck e Stanley. Chimica. (8 ° ed.). CENGAGE Learning, p. 199-203.
- Goodphy. (27 luglio 2016). Schema di Madelung. [Figura]. Tratto da: commons.wikimedia.org



Nessun utente ha ancora commentato questo articolo.