
Potenziometro (pHmetro) a cosa serve e come funziona

UN potenziometro è il dispositivo utilizzato per misurare la differenza di potenziale tra un elettrodo di lavoro e uno di riferimento, quando entrambi sono immersi in una soluzione di cui si desidera determinarne l'acidità o basicità, esprimendola come pH.
In questo modo, la potenziometria si riferisce al metodo analitico utilizzato per determinare la concentrazione di ioni H.+ in una sostanza che è in soluzione, utilizzando un potenziometro e i due elettrodi suddetti.

Nel caso dell'elettrodo di riferimento, ha un potenziale noto, costante e stabile a differenza dell'elettrodo di lavoro. Il potenziale che si sviluppa in quest'ultimo elettrodo varia in proporzione alla concentrazione di ioni H.+ che sono nella soluzione.
Questo potenziale è anche fortemente influenzato dalla temperatura alla quale viene eseguita la misura..
Indice articolo
- 1 A cosa serve?
- 2 Come funziona?
- 2.1 Elettrodi
- 2.2 Calibrazione di un potenziometro
- 3 Riferimenti
Cosa serve?
Ci sono un gran numero di processi che vengono eseguiti in campo industriale - come la produzione di farmaci, la lavorazione degli alimenti e la purificazione dell'acqua - che sono altamente sensibili alle variazioni dei livelli di pH. Per questo motivo la sua corretta misurazione è così importante.
Come accennato in precedenza, il pH è un parametro utilizzato per misurare l'acidità o l'alcalinità di una soluzione che si trova in fase acquosa analizzando la concentrazione di ioni H.+ in soluzione. Quindi, il valore del pH viene calcolato dalla seguente equazione:
pH = -log [H+]
Quindi il potenziometro viene utilizzato per misurare il pH di una sostanza in soluzione..
Quando il potenziometro è collegato ai due elettrodi immersi nella soluzione da analizzare, rileva la differenza di potenziale tra l'elettrodo di lavoro e l'elettrodo di riferimento, amplificando questo segnale e convertendolo in un valore di pH utilizzando l'equazione sopra descritta..
Come funziona?
Il funzionamento di un potenziometro si basa sul meccanismo di una cella elettrochimica, in cui sono coinvolti gli ioni H.+ nella reazione chimica della cellula per determinare la concentrazione di questi ioni nella soluzione e, in questo modo, ottenere il pH della stessa.
Quando si desidera misurare il pH di una soluzione mediante potenziometria, vengono utilizzati un potenziometro e un elettrodo; il primo è il dispositivo che determina il pH, mentre il secondo si basa sulla combinazione di un elettrodo di riferimento e un elettrodo di misura sensibile agli analiti.
In questo senso si forma un circuito attraverso il quale scorre la corrente elettrica tra gli elettrodi e la soluzione, dove svolgono la funzione di batteria quando sono immersi nella suddetta soluzione..
In questo modo, il potenziometro è progettato in modo da generare una tensione pari a zero (in unità di millivolt) quando ha un pH pari a sette; cioè neutro.
Allo stesso modo, quando si registra un aumento dei valori potenziali (con numeri positivi) significa che ci sono valori di pH più bassi, e quando si osserva una diminuzione - cioè una crescita verso numeri negativi - si parla di valori più alti..
Elettrodi
L'elettrodo di misura (o di lavoro) è costituito da un dispositivo in cui avviene la reazione in studio (ossidazione o riduzione).
Sebbene ne esistano molti tipi, è generalmente di vetro, costituito da una membrana di vetro molto sottile che ha permeabilità agli ioni H.+ dell'ambiente in cui si trova.
Inserendolo in una soluzione che abbia un pH diverso da quello della soluzione presente nella cella, si genera una differenza di potenziale tra le due facce della membrana e tale differenza può essere registrata tramite un elettrodo di riferimento..
L'elettrodo di riferimento è invece un dispositivo che presenta caratteristiche di potenziale stabile e di valore noto, normalmente utilizzato come anodo nella cella elettrochimica..
Un esempio di questo tipo di elettrodo è quello costituito da un filo d'argento, rivestito con cloruro d'argento e immerso in una soluzione di acido cloridrico diluito, o l'elettrodo di riferimento saturo di calomelano, come quello mostrato nella figura sotto.
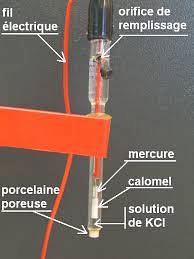
Quindi il potenziometro determina la differenza di potenziale che si genera tra gli elettrodi, sebbene solo il potenziale dell'elettrodo di lavoro dipenda dalle concentrazioni delle specie ioniche..
Calibrazione di un potenziometro
La taratura di un potenziometro deve essere effettuata tramite soluzioni tampone note (dette anche tamponi o soluzioni tampone), che consistono in sistemi a pH praticamente invariabile che contengono una sostanza debole e le sue specie coniugate..
Ogni tampone ha un pH specifico, che può essere acido (pH<7), básico (pH>7) o neutro (pH = 7), e possono essere acquistati in commercio già standardizzati o preparati in laboratorio con reagenti certificati e utilizzando procedure consolidate e validate..
Poiché i potenziometri misurano il valore del pH entro un intervallo considerato ampio, è necessario sapere se l'analita ha un pH maggiore o minore di sette per procedere con la sua corretta calibrazione..
Pertanto, per i campioni il cui pH dovrebbe essere basico, dovrebbe essere calibrato con una soluzione tampone con un pH uguale a sette e un'altra con un pH più alto (normalmente si usa uno di pH dieci)..
D'altra parte, per i campioni con un pH acido previsto, si calibra con una soluzione tampone con un pH uguale a sette e un'altra con un pH inferiore (normalmente si usa un pH quattro)..
Infine, la ricalibrazione di questo strumento di misura deve essere eseguita prima e dopo ogni utilizzo, registrandone i risultati, compresa la data e l'ora in cui sono stati effettuati e le caratteristiche delle soluzioni tampone utilizzate per controllarlo..
Riferimenti
- Wikipedia. (s.f.). misuratore di acidita. Estratto da es.wikipedia.org
- Chang, R. (2007). Chimica, nona edizione. (McGraw-Hill).
- Westcott, C. (2012). Misurazioni del pH. Ottenuto da books.google.co.ve
- Nielsen, C. (1996). Gestione del laboratorio analitico: chiaro e semplice. Ottenuto da books.google.co.ve
- Kenkel, J. (2010). Chimica analitica per tecnici, terza edizione. Ottenuto da books.google.co.ve
- Cavo, M. (2005). Calibrazione: una guida del tecnico. Ottenuto da books.google.co.ve



Nessun utente ha ancora commentato questo articolo.