
Struttura, proprietà e usi dell'idrossido di berillio (Be (OH) 2)

Il berillio idrossido È un composto chimico costituito da due molecole di idrossido (OH) e una molecola di berillio (Be). La sua formula chimica è Be (OH)Due ed è caratterizzato dall'essere una specie anfotera. In generale, può essere ottenuto dalla reazione tra il monossido di berillio e l'acqua, secondo la seguente reazione chimica: BeO + HDueO → Be (OH)Due
D'altra parte, questa sostanza anfotera ha una configurazione molecolare lineare. Tuttavia, varie strutture possono essere ottenute dall'idrossido di berillio: forma alfa e beta, come minerale e in fase vapore, a seconda del metodo utilizzato..
Indice articolo
- 1 Struttura chimica
- 1.1 Alfa berillio idrossido
- 1.2 Beta berillio idrossido
- 1.3 Berillio idrossido nei minerali
- 1.4 Vapore di idrossido di berillio
- 2 Proprietà
- 2.1 Aspetto
- 2.2 Proprietà termochimiche
- 2.3 Solubilità
- 2.4 Rischi di esposizione
- 3 usi
- 4 Ottenimento
- 4.1 Ottenere il berillio metallico
- 5 Riferimenti
Struttura chimica
Questo composto chimico può essere trovato in quattro diverse forme:
Idrossido di alfa berillio
L'aggiunta di qualsiasi reagente di base come l'idrossido di sodio (NaOH) a una soluzione di sale di berillio dà la forma alfa (α) di idrossido di berillio. Di seguito è riportato un esempio:
2NaOH (diluito) + BeClDue → Be (OH)Due↓ + 2NaCl
2NaOH (diluito) + BeSO4 → Be (OH)Due↓ + NaDueSW4
Beta berillio idrossido
La degenerazione di questo prodotto alfa forma una struttura cristallina tetragonale meta-stabile, che dopo un periodo di tempo prolungato si trasforma in una struttura rombica chiamata beta (β) berillio idrossido..
Questa forma beta si ottiene anche come precipitato da una soluzione di sodio berillio per idrolisi in condizioni prossime al punto di fusione..
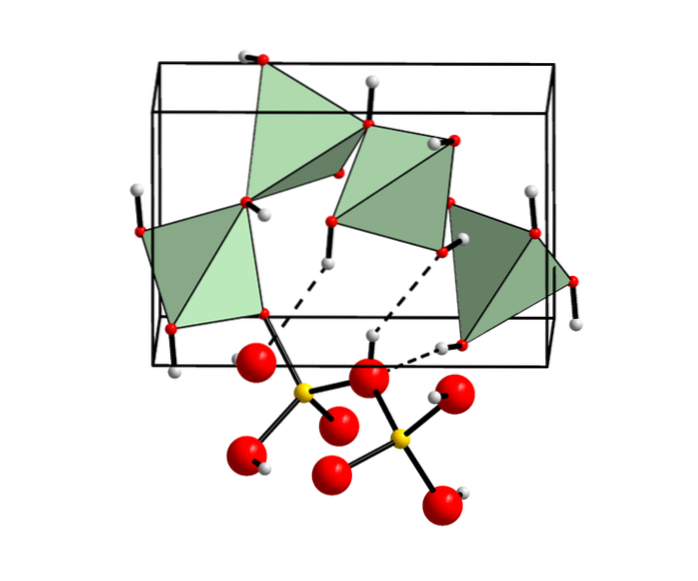
Berillio idrossido nei minerali
Sebbene non sia usuale, l'idrossido di berillio si trova come un minerale cristallino noto come behoite (chiamato in questo modo in riferimento alla sua composizione chimica).
Si manifesta nelle pegmatiti granitiche formate dall'alterazione della Gadolinite (minerali del gruppo dei silicati) nelle fumarole vulcaniche.
Questo minerale relativamente nuovo è stato scoperto per la prima volta nel 1964 e attualmente è stato trovato solo nelle pegmatiti di granito situate negli stati del Texas e Utah negli Stati Uniti..
Vapore di idrossido di berillio
A temperature superiori a 1200 ° C (2190 ° C), l'idrossido di berillio esiste nella fase vapore. Si ottiene dalla reazione tra vapore acqueo e ossido di berillio (BeO).
Allo stesso modo, il vapore risultante ha una pressione parziale di 73 Pa, misurata ad una temperatura di 1500 ° C..
Proprietà
L'idrossido di berillio ha una massa molare o un peso molecolare approssimativo di 43,0268 g / mol e una densità di 1,92 g / cm3. Il suo punto di fusione è alla temperatura di 1000 ° C, a cui inizia la sua decomposizione.
Come minerale, Be (OH)Due (behoite) ha una durezza di 4 e la sua densità è compresa tra 1,91 g / cm3 e 1,93 g / cm3.
Aspetto
L'idrossido di berillio è un solido bianco, che nella sua forma alfa ha un aspetto gelatinoso e amorfo. D'altra parte, la forma beta di questo composto è costituita da una struttura cristallina ben definita, ortorombica e stabile..
Si può dire che la morfologia del minerale Be (OH)Due è vario, perché si può trovare come cristalli reticolari, arborescenti o aggregati sferici. Allo stesso modo, è disponibile nei colori bianco, rosa, bluastro e persino incolore e con una lucentezza vitrea grassa..
Proprietà termochimiche
Entalpia di formazione: -902,5 kJ / mol
Energia di Gibbs: -815,0 kJ / mol
Entropia di formazione: 45,5 J / mol
Capacità termica: 62,1 J / mol
Capacità termica specifica: 1.443 J / K
Entalpia di formazione standard: -20,98 kJ / g
Solubilità
L'idrossido di berillio è di carattere anfotero, quindi è in grado di donare o accettare protoni e si dissolve in mezzi acidi e basici in una reazione acido-base, producendo sale e acqua..
In questo senso, la solubilità di Be (OH)Due in acqua è limitato dal prodotto di solubilità Kps(H2O), che è uguale a 6,92 × 10-22.
Rischi di esposizione
Il limite legale di esposizione umana consentito (PEL o OSHA) di una sostanza di idrossido di berillio definito per una concentrazione massima compresa tra 0,002 mg / m3 e 0,005 mg / m3 è di 8 ore e per una concentrazione di 0,0225 mg / m3 un tempo massimo di 30 minuti.
Queste limitazioni sono dovute al fatto che il berillio è classificato come cancerogeno di tipo A1 (cancerogeno per l'uomo, in base alla quantità di prove provenienti da studi epidemiologici).
Applicazioni
L'uso dell'idrossido di berillio come materia prima per la lavorazione di alcuni prodotti è molto limitato (e insolito). Tuttavia, è un composto utilizzato come reagente principale per la sintesi di altri composti e l'ottenimento di berillio metallico..
Ottenere
L'ossido di berillio (BeO) è il composto chimico di berillio ad elevata purezza più utilizzato nell'industria. È caratterizzato come un solido incolore con proprietà di isolamento elettrico e alta conduttività termica.
In questo senso, il processo per la sua sintesi (in qualità tecnica) nell'industria primaria si svolge come segue:
- L'idrossido di berillio si dissolve in acido solforico (H.DueSW4).
- Una volta eseguita la reazione, la soluzione viene filtrata, in modo da eliminare le impurità insolubili di ossido o solfato..
- Il filtrato viene sottoposto ad evaporazione per concentrare il prodotto, che viene raffreddato per ottenere cristalli di berillio solfato BeSO4.
- Il bacio4 calcina a una temperatura specifica compresa tra 1100 ° C e 1400 ° C.
Il prodotto finale (BeO) viene utilizzato per realizzare pezzi speciali in ceramica per uso industriale..
Ottenere berillio metallico
Durante l'estrazione e la lavorazione dei minerali di berillio, vengono generate impurità, come l'ossido di berillio e l'idrossido di berillio. Quest'ultimo subisce una serie di trasformazioni fino ad ottenere il berillio metallico.
Be (OH) viene reagitoDue con una soluzione di bifluoruro di ammonio:
Essere (oh)Due + 2 (NH4) HFDue → (NH4)DueBeF4 + 2 hDueO
Il (NH4)DueBeF4 è soggetto ad un aumento di temperatura, subendo decomposizione termica:
(NH4)DueBeF4 → 2NH3 + 2HF + BeFDue
Infine, la riduzione del fluoruro di berillio a una temperatura di 1300 ° C con magnesio (Mg) si traduce in berillio metallico:
BeFDue + Mg → Be + MgFDue
Il berillio è utilizzato nelle leghe metalliche, nella produzione di componenti elettronici, nella produzione di schermi e finestre di radiazione utilizzate nelle macchine a raggi X..
Riferimenti
- Wikipedia. (s.f.). Berillio idrossido. Estratto da en.wikipedia.org
- Holleman, A. F.; Wiberg, E. e Wiberg, N. (2001). Idrossido di berillio. Ottenuto da books.google.co.ve
- Editoria, M. D. (s.f.). Behoite. Estratto da handbookofmineralogy.org
- Tutte le reazioni. (s.f.). Berillio idrossido Be (OH)Due. Estratto da allreactions.com
- PubChem. (s.f.). Idrossido di berillio. Recupero da pubchem.ncbi.nlm.nih.gov
- Walsh, K. A. e Vidal, E. E. (2009). Chimica e lavorazione del berillio. Ottenuto da books.google.co.ve



Nessun utente ha ancora commentato questo articolo.