
Storia, proprietà, gruppi, usi dei non metalli
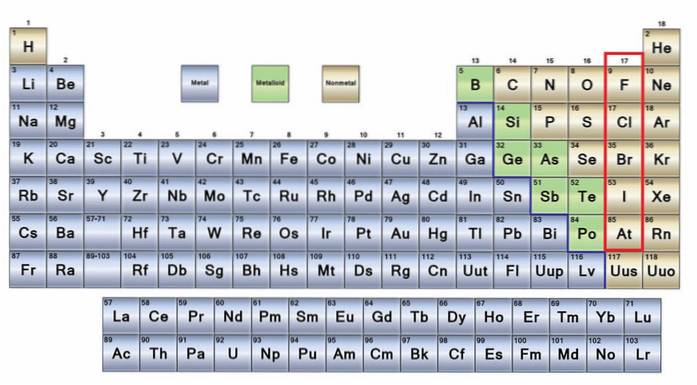
Il niente metalli Sono un gruppo di elementi che si trovano sul lato destro della tavola periodica, ad eccezione dell'idrogeno che si trova nel gruppo 1 (IA), insieme ai metalli alcalini. Se vuoi sapere cosa sono, devi guardare nell'angolo in alto a destra del blocco p.
Gli atomi non metallici sono relativamente piccoli e il loro guscio elettronico esterno ha un numero elevato di elettroni. Tra gli elementi non metallici possono essere solidi, liquidi e gas; sebbene la maggior parte di loro sia allo stato gassoso, molti di loro arricchiscono l'atmosfera.
Una buona parte dei non metalli è presente in tutti gli esseri viventi sotto forma di composti e macromolecole. Ad esempio: carbonio, ossigeno e idrogeno sono presenti in tutte le proteine, lipidi, carboidrati e acidi nucleici.
Il fosforo è presente in tutti gli acidi nucleici e in alcuni carboidrati e lipidi. Lo zolfo si trova in molte proteine. L'azoto fa parte di tutti gli acidi nucleici e le proteine.
D'altra parte, il sottosuolo, i gas metano e il petrolio greggio sono composti quasi interamente da elementi non metallici. Infatti, gli idrocarburi (carbonio e idrogeno) danno un'idea di quanto siano abbondanti i non metalli nonostante il loro minor numero di elementi nella tavola periodica..
Indice articolo
- 1 Storia
- 2 Proprietà fisiche e chimiche
- 2.1 Fisica
- 2.2 Chimica
- 3 Gruppi di non metalli ed elementi
- 3.1 Gruppo 1
- 3.2 Gruppo 14
- 3.3 Gruppo 15
- 3.4 Gruppo 16
- 3.5 Gruppo 17
- 3.6 Gruppo 18
- 4 Usi
- 4.1 Idrogeno
- 4.2 Carbonio
- 4.3 Azoto
- 4.4 Fosforo
- 4.5 Ossigeno
- 4.6 Zolfo
- 4.7 Selenio
- 4.8 Fluoro
- 4.9 Cloro
- 4.10 Bromo
- 4.11 Iodio
- 4.12 Elio
- 4.13 Neon
- 4.14 Argon
- 4.15 Xenon
- 4.16 Radon
- 5 Riferimenti
Storia
Fin dall'antichità (3750 a.C.) gli egizi usavano il carbone per ridurre il rame presente nei loro minerali, come corvellite e malachite.
Nel 1669, Hennin Brand riuscì a isolare il fosforo dall'urina raccolta. Henry Cavendish (1776) riuscì a identificare l'idrogeno, sebbene diversi ricercatori, tra cui Robert Boyle (1670), produssero idrogeno facendo reagire un acido forte con un metallo.
Carl Scheele produsse ossigeno riscaldando ossido di mercurio con nitrati (1771). Curtois riuscì a isolare lo iodio, mentre cercava di preparare il salnitro dalle alghe (1811). Balard e Gmelin hanno isolato il bromo (1825).
Nel 1868, Janssen e Lockger scoprirono indipendentemente l'elio osservando una linea gialla nello studio dello spettro della luce solare che non apparteneva a un altro elemento. Moissan è riuscito a isolare il fluoruro (1886).
Nel 1894, Lord Rayleigh e Ramsey scoprirono l'argon studiando le proprietà dell'azoto. Ramsay e Travers (1898) isolarono krypton, neon e xeno dall'argon liquido mediante distillazione criogenica dell'aria..
Proprietà fisiche e chimiche

Fisico
Alcune delle proprietà fisiche dei non metalli sono:
-Hanno una bassa conduttanza elettrica, ad eccezione del carbonio sotto forma di grafite, che è un buon conduttore di elettricità..
-Possono apparire sotto l'aspetto fisico di solidi, liquidi o gas.
-Hanno una bassa conduttanza termica, ad eccezione del carbonio sotto forma di diamante, che non si comporta come un isolante termico..
-Hanno una lucentezza bassa, a differenza della lucentezza metallica dei metalli.
-I solidi non metallici sono fragili, quindi non sono duttili o malleabili.
-Hanno punti di fusione e ebollizione bassi.
-Possono avere diverse strutture cristalline. Quindi fosforo, ossigeno e fluoro hanno una struttura cristallina cubica; idrogeno, carbonio e azoto, esagonali; e zolfo, cloro, bromo e iodio, ortorombico.
Chimica
I non metalli sono caratterizzati dall'avere un'elevata energia di ionizzazione e un alto valore di elettronegatività. Il fluoro, ad esempio, ha la più alta elettronegatività (3,98), essendo l'elemento più reattivo dei non metalli.
Ma sorprendentemente, i gas nobili elio (5,5) e neon (4,84) hanno l'elettronegatività più elevata. Tuttavia, sono chimicamente inerti perché i gusci elettronici esterni sono pieni..
I non metalli formano composti ionici con i metalli e covalenti con i non metalli.
Si trovano elementi non metallici che formano molecole biatomiche, legate da legami covalenti. Nel frattempo, gli atomi dei gas nobili sono sotto forma di unità atomiche.
Formano ossidi acidi che, reagendo con l'acqua, danno origine ad acidi.
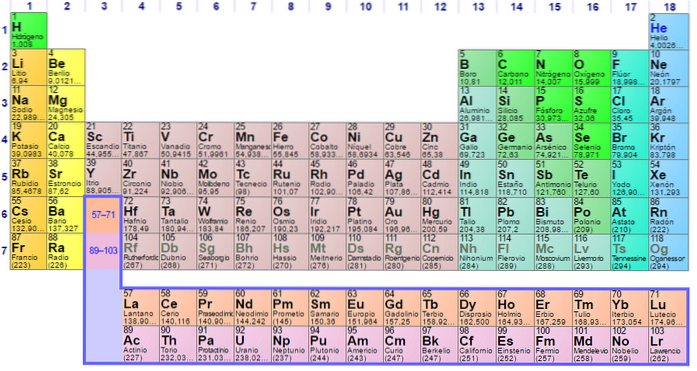
Gruppi ed elementi non metallici
Gruppo 1
È costituito da idrogeno, un gas incolore e inodore, biatomico. Stato di ossidazione +1. Ha una densità inferiore a quella dell'aria. Allo stato solido ha una struttura cristallina esagonale. L'idrogeno è un elemento scarsamente reattivo.
Gruppo 14
Il carbonio è l'unico non metallo in questo gruppo. Il carbonio sotto forma di grafite è un solido brillante, con una struttura cristallina esagonale. Ha un'elevata conduttività elettrica. I suoi stati di ossidazione più comuni sono +2 e +4.
Gruppo 15
Azoto
Gas incolore e inodore. È un elemento leggermente reattivo e leggermente più denso dell'aria. Stati di ossidazione più comuni: -3 e +5. Forma molecole biatomiche, NDue.
Incontro
Solido, il suo colore può essere bianco, giallo o nero. Poco reattivo. Struttura cristallina ortorombica. Elettronegatività 2.1. Stati di ossidazione più comuni: -3 e +5.
Gruppo 16
Ossigeno
Gas incolore o blu pallido, inodore. Generalmente non reattivo. Struttura in cristallo cubico. È un isolante e un forte agente ossidante. Elettronegatività 3.5. Stato di ossidazione -2
Zolfo
Solido giallo brillante, fragile, moderatamente reattivo. Struttura cristallina ortorombica. Forma legami covalenti. Elettronegatività 2.5. Stati di ossidazione più comuni: -2, +2, +4 e +6.
Selenio
Grigio solido o rossastro al nero. Il selenio grigio mostra una conduttività elettrica sensibile alla luce. È un solido morbido e fragile. Elettronegatività 2.4. Stati di ossidazione: -2, +2, +4 e +6.
Gruppo 17
Fluoro
È un gas giallo pallido, molto tossico. È un elemento molto reattivo. Si presenta come molecole biatomiche, FDue. Allo stato solido cristallizza in forma cubica. Elettronegatività 3.98. Stati di ossidazione -1.
Cloro
È un gas giallo-verde. Presenta molecole biatomiche, ClDue. È molto reattivo. Allo stato solido la struttura cristallina è ortorombica. Elettronegatività 3.0. Stati di ossidazione: - 1, +1, +3, +5, +7.
Bromo
È un liquido rosso-marrone. Elettronegatività 2.8. Stati di ossidazione -1, +1, +3, +5 e +7.
Iodio
È un solido nero che quando sublimato emette un vapore viola. Struttura cristallina ortorombica. Gli ioduri metallici sono ionici. Elettronegatività 2.5. Stati di ossidazione: -1, +1, +3, +5 e +7.
Astatus
È un nero solido. Struttura cristallina cubica centrata sulla faccia. Elettronegatività 2.2. È un debole agente ossidante.
Gruppo 18
Elio
Ha un'elevata conducibilità termica. Elettronegatività 5.5. È chimicamente inerte e non infiammabile. Bassa densità e alta fluidità.
Neon
Elevata capacità di raffreddamento allo stato liquido. Elettronegatività 4.84. È il meno reattivo dei gas nobili.
Argon
È più denso dell'aria. Chimicamente inerte. Elettronegatività 3.2.
Krypton
Elettronegatività 2.94. Può reagire con il fluoro per formare difluoruro di kripton (KrFDue).
Xeno
Attraversa la barriera emato-encefalica. Risponde alla corrente elettrica producendo luce. Elettronegatività 2.2. Forma complessi con fluoro, oro e ossigeno.
Radon
È un elemento radioattivo. Elettronegatività 2.06. Forma composti con fluoro (RnFDue) e con ossigeno (RnO3).
Applicazioni
Idrogeno
Viene utilizzato nella propulsione a razzo e come carburante nei motori delle automobili che utilizzano l'idrogeno. Viene utilizzato nella sintesi dell'ammoniaca (NH3) e nell'idrogenazione dei grassi.
Carbonio

La grafite viene utilizzata nella produzione di matite e fibre ad alta resistenza utilizzate nella produzione di articoli sportivi. Il diamante viene utilizzato come gemma di grande valore e nei fori come abrasivo. L'anidride carbonica è utilizzata nella produzione di bevande gassate.
Azoto
Viene utilizzato nella produzione di ammoniaca, acido nitrico e urea. L'azoto è un elemento essenziale per le piante e viene utilizzato nella produzione di fertilizzanti.
Incontro
Il fosforo bianco è usato come rodenticida, insetticida e nell'industria dei fuochi d'artificio. Il fosforo rosso viene utilizzato per creare fiammiferi. I suoi composti sono utilizzati anche nella produzione di fertilizzanti.
Ossigeno
L'ossigeno è utilizzato nella produzione di acciaio, plastica e tessuti. Viene anche utilizzato nei propellenti per razzi, ossigenoterapia e assistenza respiratoria in aerei, sottomarini e voli spaziali..
Zolfo
Viene utilizzato come materia prima per la produzione di acido solforico, polvere da sparo e nella vulcanizzazione delle gomme. I solfiti sono usati per sbiancare la carta e come fungicida.
Selenio
È usato per conferire una tinta rosso scarlatto al vetro. Viene anche utilizzato per neutralizzare la sfumatura verdastra prodotta dalla contaminazione del vetro con composti di ferro. Viene utilizzato nelle fotocellule con applicazione in porte e ascensori.
Fluoro

Viene aggiunto ai dentifrici per prevenire la carie. Il fluoruro di idrogeno viene utilizzato come materia prima per il teflon. Il fluoro monoatomico viene utilizzato nella produzione di semiconduttori.
Cloro
Viene utilizzato nella metallurgia estrattiva e nella clorazione degli idrocarburi per la fabbricazione di vari prodotti come il PVC. Il cloro è utilizzato nella pasta di legno e nelle candeggine tessili. Viene anche usato come disinfettante per l'acqua.
Bromo
Viene utilizzato nella preparazione del bromuro d'argento per lenti sensibili alla luce e in pellicole fotografiche Viene anche utilizzato nella produzione del sedativo bromuro di sodio e dibrometano, un componente antiknock della benzina.
Iodio
Lo ioduro di potassio (KI) viene aggiunto per prevenire il gozzo tiroideo. La tintura di iodio è usata come antisettico e germicida. Lo iodio fa parte degli ormoni tiroidei.
Elio
Viene utilizzato nel riempimento di mongolfiere e miscelato con ossigeno per la respirazione in acque profonde. Viene utilizzato per la saldatura in atmosfera inerte e aiuta anche a mantenere temperature molto basse nella ricerca.
Neon
In tubi di vetro illuminati dall'azione dell'elettricità (luci al neon rosse).
Argon
Utilizzato per creare un'atmosfera per la saldatura e durante il riempimento di lampadine a incandescenza.
Xeno
Una miscela di xeno e krypton viene utilizzata nella produzione di flash ad alta intensità in brevi esposizioni fotografiche.
Radon
Viene utilizzato nel trattamento dei tumori cancerosi mediante radioterapia.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Shiver & Atkins. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Mathews, C. K., van Holde, K. E. e Ahern, K. G. (2002). Biochimica. Terza edizione. Modificare. Pearson-Addison Wesley
- Helmenstine, Anne Marie, Ph.D. (06 ottobre 2019). Quali sono le proprietà dei non metalli? Estratto da: thoughtco.com
- Wikipedia. (2019). Metalloide. Estratto da: en.wikipedia.org
- The Editors of Encyclopaedia Britannica. (5 aprile 2016). Metalloide. Encyclopædia Britannica. Estratto da: britannica.com
- José M. Gavira Vallejo. (2016, 27 gennaio). Quali sono gli elementi poligenici? E gli icosageni, i crystallógens, i calcogeni ...? Estratto da: triplenlace.com



Nessun utente ha ancora commentato questo articolo.