
Numero atomico
Qual è il numero atomico?
Il numero atomico di un elemento chimico indica il numero di protoni contenuti nel nucleo atomico di quell'elemento. Nel caso in cui fosse un atomo neutro, il numero atomico coinciderà con il numero di elettroni di detto elemento.
Come è noto, il nucleo atomico è costituito da protoni e neutroni. I protoni hanno una carica positiva e il loro valore coincide con il valore assoluto della carica negativa dell'elettrone, che è 1,6 x 10-19 coulomb nelle unità del Sistema Internazionale.
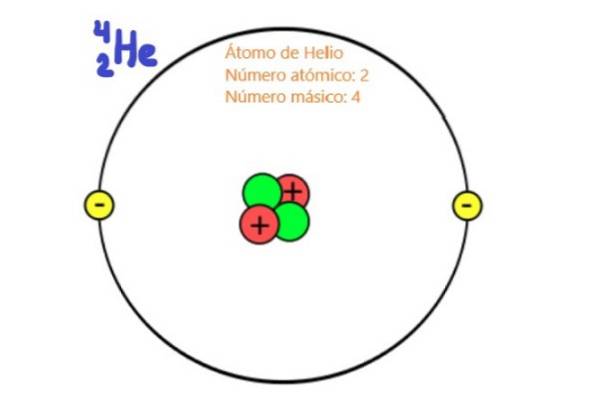
Poiché sono particelle del nucleo atomico, protoni e neutroni sono noti come nucleoni. Sono queste particelle che praticamente determinano la massa dell'atomo, poiché i nucleoni sono circa duemila volte più massicci degli elettroni dell'atomo. Per questo motivo viene chiamato il numero di nucleoni in un atomo numero di Massa.
comunque, il numero atomico è quello che determina l'affinità chimica degli elementi atomici, perché negli atomi neutri questo numero coincide con il numero di elettroni.
Rappresentazione di numeri atomici
Nella tavola periodica, il simbolo X di un elemento chimico è accompagnato in basso a sinistra dal numero Z che rappresenta il numero atomico di detto elemento, mentre il numero di massa è indicato in alto a sinistra del simbolo chimico dell'elemento. PER.
La figura seguente mostra questa notazione:
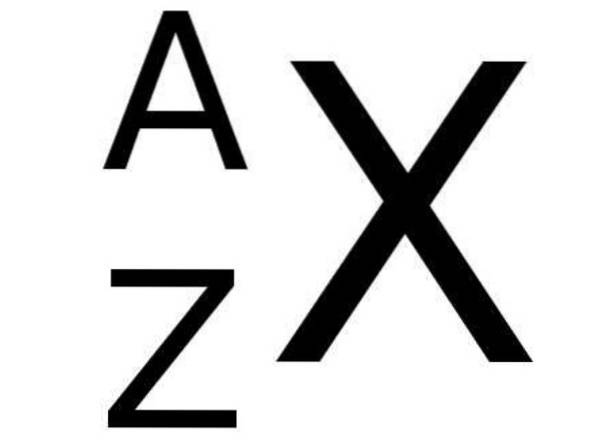
E di seguito, la tabella 1 mostra alcuni esempi di elementi chimici con le rispettive notazioni e numeri atomici e di massa:
Tabella 1
| Elemento | Notazione | Numero atomico Z | Numero di massa A |
|---|---|---|---|
| Idrogeno | 1 1 H | 1 | 1 |
| Carbonio | 12 6 C | 6 | 12 |
| Ossigeno | 16 8 O | 8 | 16 |
| Uranio | 238 92 O | 92 | 238 |
Numero atomico e ordine degli elementi nella tavola periodica
La tavola periodica degli elementi chimici permette la disposizione sequenziale e in ordine crescente degli elementi, secondo il valore del loro numero atomico.
Ne sono noti almeno 118, partendo dall'idrogeno fino ad arrivare all'elemento 118 che è il oganeson -prima chiamato ununoctium-, il cui simbolo chimico è Og e il suo numero di massa è 294.
I primi 10 elementi chimici con ordine crescente in numero atomico sono molto più familiari. Quindi ad esempio abbiamo il più noto:
- Idrogeno, H
- Elio, He
- Litio, Li
- Berillio, Be
- Boro, B
- Carbonio, C
- Azoto, N
- Ossigeno, O
- Fluoro, F
- Neon, Ne

Configurazione elettronica
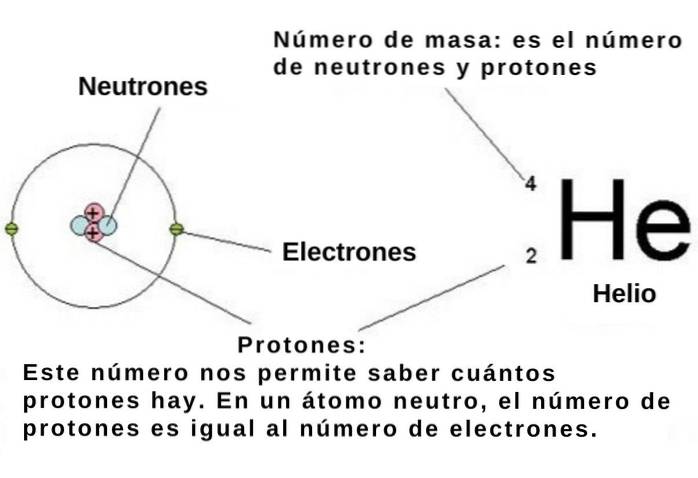
Il numero atomico indica il numero di protoni nel nucleo atomico di un elemento chimico e ogni protone, come abbiamo detto, ha una carica elementare positiva di 1.602 x 10-19 C.
Se l'atomo è neutro, il numero di elettroni elementari caricati negativamente è -1,602 x10-19 C deve essere uguale al numero atomico. Quindi, conoscendo la posizione numerica di un elemento chimico nella tavola periodica, si conosce anche il suo numero di elettroni..
Nell'atomo questi elettroni occupano regioni chiamate orbitali, che dipendono dall'energia e dal momento angolare dell'elettrone. A sua volta, sia l'energia che il momento angolare degli elettroni nell'atomo vengono quantizzati. Ciò significa che possono assumere solo alcuni valori discreti.
Ora, gli orbitali vengono popolati con elettroni dall'energia inferiore a quella superiore, seguendo alcune regole che determinano la configurazione elettronica.
In questo modo, il numero di elettroni negli orbitali o livelli più esterni di un atomo stabilisce i legami che può formare con altri atomi per formare molecole. Questo numero dipende dalla configurazione elettronica e dal numero atomico.
Numeri quantistici
L'energia di un elettrone nell'atomo è determinata dal suo numero quantico principale n, che può assumere valori interi 1, 2, 3 ...
Il momento angolare dell'elettrone nell'atomo è determinato dal numero quantico secondario l (lettera ele) ei suoi valori dipendono dal n.
Ad esempio, per n = 2 il numero quantico secondario assume i valori da 0 a n-1, cioè: 0 e 1. Allo stesso modo, per n = 1 che è il livello di energia più basso, il numero quantico secondario l è solo assume il valore 0.
I numeri quantici secondari 0, 1, 2, 3 sono alternativamente indicati dalle lettere s, p, de f. Gli orbitali s sono sferici e gli orbitali p sono lobulati.
Ci sono altri due numeri quantici:
- Il numero quantico magnetico ml, che assume i valori da -l a + l passando per zero.
- Il numero quantico di spin S, che assume solo valori + ½ e -½ ed è una caratteristica dell'elettrone.
Infine c'è il principio di esclusione di Pauli, che afferma che due elettroni non possono avere tutti e quattro i numeri quantici identici. Come conseguenza di questo principio, un orbitale può avere un massimo di due elettroni con spin opposto.
Schema di configurazione elettronica
Il diagramma di configurazione degli elettroni viene utilizzato per conoscere l'ordine di riempimento degli elettroni dagli orbitali a più bassa energia a quelli a più alta energia, una volta noto il numero atomico di un elemento chimico. La Figura 4 mostra questo diagramma:
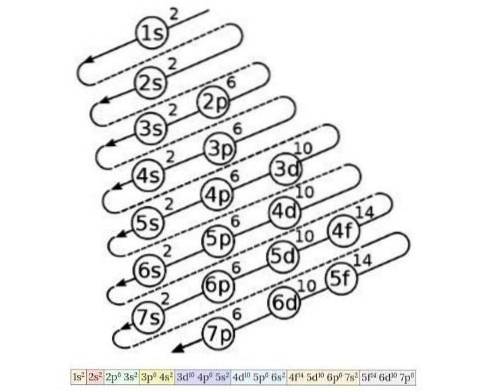
L'idea qui delineata è la seguente: il primo numero indica il numero quantico principale, poi la lettera indica il numero quantico secondario e infine il numero in apice indica il numero massimo di elettroni possibile in quell'orbitale..
Esempio
Configurazione elettronica di carbonio e silicio
Come indicato sopra, il carbonio ha il numero atomico 6, il che significa che ha 6 elettroni che sono distribuiti come segue: 1s2 2s2 2p2. Da parte sua, il silicio ha il numero atomico 14 ei suoi elettroni sono distribuiti in questo altro modo: 1s2 2s2 2p6 3s2 3p2.
Entrambi gli elementi sono nella stessa colonna della tavola periodica, perché, anche se hanno numeri atomici diversi, hanno la stessa configurazione elettronica nella tavola periodica. orbitale più esterno.
Riferimenti
- Connor, N. Cos'è Nucleon - Struttura del nucleo atomico - Definizione. Estratto da: periodic-table.org.
- Vertice dei popoli. Numero atomico: cos'è, come viene rappresentato. Estratto da: cumbrepuebloscop20.org
- Lifeder. Cos'è la periodicità chimica? Estratto da: lifeder.com
- Wikipedia. Configurazione elettronica. Estratto da: es.wikipedia.com
- Wikipedia. Numero atomico. Estratto da: es.wikipedia.com



Nessun utente ha ancora commentato questo articolo.