
Struttura, proprietà e usi del nitrito di potassio (KNO2)

Il nitrito di potassio è un sale inorganico la cui formula chimica è KNODue, che è chimicamente e farmacologicamente correlato al nitrato di potassio, KNO3. Il suo aspetto fisico è costituito da cristalli bianco-giallastri, altamente igroscopici e quindi deliquescenti; cioè si dissolvono rapidamente in ambienti umidi.
La sua formula indica che la proporzione di K ioni+ e noDue- è 1: 1 e sono tenuti insieme da forze elettrostatiche o legami ionici. Nessuna fonte naturale pura sembra essere stata trovata per i suoi cristalli, sebbene gli anioni nitriti possano essere trovati nel suolo, nei fertilizzanti, nelle piante e negli animali..

L'immagine sopra mostra l'aspetto dei cristalli KNODue, con pronunciati toni gialli. Se questi cristalli vengono lasciati a contatto con l'aria, assorbiranno l'umidità fino a diventare una soluzione acquosa; soluzione che ha generato controversie sul fatto che il suo utilizzo per scopi medici sia vantaggioso o meno.
I suoi cristalli, invece, in piccolissime quantità (200 ppm), vengono utilizzati per salinizzare le carni e garantirne la conservazione contro l'azione batterica. Allo stesso modo, il KNODue migliora il colore delle carni rendendole più rossastre; tuttavia, è soggetto a diverse restrizioni per evitare gli effetti tossici di questo sale nel corpo.
Indice articolo
- 1 Struttura del nitrito di potassio
- 2 Proprietà
- 2.1 Massa molecolare
- 2.2 Densità
- 2.3 Punto di fusione
- 2.4 Punto di ebollizione
- 2.5 Solubilità in acqua
- 2.6 Deliquescenza
- 2.7 Solubilità in altri solventi
- 2.8 pH
- 3 Nomenclatura
- 4 Ottenimento
- 5 Usi
- 5.1 Additivo e reagente
- 5.2 Antidoto
- 5.3 Medici
- 6 Riferimenti
Struttura del nitrito di potassio
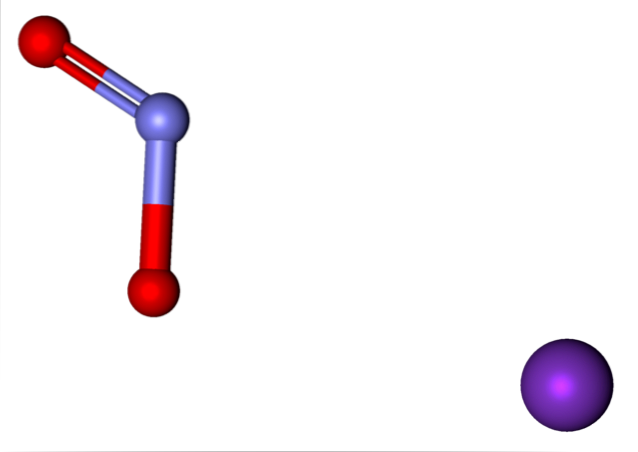
Gli ioni presenti nel nitrito di potassio sono mostrati sopra. Il catione K.+ corrisponde alla sfera viola, mentre l'anione NODue- è rappresentato dalle sfere bluastre e rosse.
Anione NODue- mostrato con un legame doppio e uno singolo [O = N-O]-; ma in realtà, entrambi i legami sono un prodotto uguale della risonanza della carica negativa tra di loro.
Ioni K+ e noDue- si attraggono nello spazio fino a quando non organizzano un modello strutturale con la minima energia; è qui che le repulsioni tra cariche uguali sono minime. E così creano cristalli KNODue, la cui cella unitaria è suscettibile ai cambiamenti di temperatura, quali transizioni di fase.
Ad esempio, a basse temperature (meno di 25 ° C) cristalli KNODue adottare un sistema monoclino (fase I). Quando la temperatura supera i 25 ° C, si verifica una transizione di fase da monoclino a romboedrico (fase II). Infine, sopra i 40 ° C i cristalli KNODue cambia per essere cubico (fase III).
Allo stesso modo, il KNODue può presentare altre fasi cristalline (fasi IV, V e VI) ad alte pressioni. Con questo, gli ioni K.+ e noDue- finiscono per muoversi e ordinare in modi diversi nei loro cristalli puri.
Proprietà
Massa molecolare
85,1038 g / mol.
Densità
1,9150 g / mL.
Punto di fusione
440,02 ° C (ma inizia a decomporsi da 350 ° C, emettendo fumi tossici).
Punto di ebollizione
537 ° C (esplode).
Solubilità dell'acqua
312 g / 100 g di acqua a 25 ° C.
Deliquescenza
La sua solubilità in acqua è tale da risultare igroscopica; tanto che mostra deliquescenza, assorbendo abbastanza umidità da dissolversi. Questa affinità per l'acqua può essere dovuta alla stabilità energetica che ottengono gli ioni K.+ quando idratato, così come una bassa entalpia reticolare per i cristalli KNODue.
I cristalli possono assorbire l'acqua senza dissolversi per diventare un idrato, KNODueHDueO. Nell'idrato si trova la molecola d'acqua che accompagna gli ioni, che modifica la struttura cristallina.
Questo idrato (o più di essi), può essere formato al di sotto di -9 ° C; a temperature più elevate l'acqua scioglie e idrata gli ioni deformando il cristallo.
Solubilità in altri solventi
Leggermente solubile in alcoli caldi e molto solubile in ammoniaca.
pH
6-9. Le sue soluzioni acquose sono quindi alcaline, poiché l'anione NODue- può essere idrolizzato.
Nomenclatura
Al KNODue può anche essere denominato in altri modi. "Nitrito di potassio" corrisponde al nome di questo sale secondo la nomenclatura stock; 'nitrito di potassio', secondo la nomenclatura sistematica, in cui si evidenzia l'unica valenza del potassio, +1; e diossonitrato di potassio (III), secondo la nomenclatura sistematica.
Il nome "diossonitrato di potassio (III)" evidenzia la valenza +3 dell'atomo di azoto. Sebbene sia il nome più consigliato dalla IUPAC per KNODue, Il "nitrito di potassio" continua ad essere il più comodo e il più facile da ricordare.
Ottenere
Il modo più diretto per sintetizzarlo, ma con una resa inferiore, è attraverso la decomposizione termica del nitrato di potassio o del salnitro a 400 ° C o più:
2KNO3 => KNODue + ODue
Tuttavia, parte del KNODue Finisce per essere decomposto dal calore, oltre ad altri prodotti che si formano.
Un altro metodo per prepararlo o sintetizzarlo con una resa maggiore è ridurre il KNO3 in presenza di piombo, rame o zinco. L'equazione per questa reazione è la seguente:
KNO3 + Pb => KNODue + PbO
Il nitrato di potassio e il piombo vengono mescolati stechiometricamente in una padella di ferro, dove si sciolgono con costante agitazione e riscaldamento per mezz'ora. L'ossido di piombo (II) è di colore giallo e la massa risultante viene polverizzata a caldo e trattata con acqua bollente. Quindi la miscela calda viene filtrata.
Il filtrato caldo viene gorgogliato con anidride carbonica per cinque minuti, che farà precipitare il carbonato di piombo, PbCO3, insolubile. In questo modo il piombo viene separato dal filtrato. L'acido nitrico diluito viene aggiunto al filtrato fino a quando il pH è neutro, viene lasciato raffreddare e infine l'acqua viene evaporata in modo che si formino i cristalli di KNO.Due.
Applicazioni
Additivo e reagente
Il nitrito di potassio viene utilizzato come additivo per curare la carne rossa, mantenendo il suo sapore e il suo colore più a lungo durante la conservazione, ritardando l'azione dei batteri e di alcune tossine, come il botulino. Pertanto, mostra un'azione antibatterica.
Il KNODue si ossida a NO, che reagisce con la mioglobina nella carne e, di conseguenza, finisce per cambiare il suo colore rosso naturale. Successivamente, quando la carne è cotta, acquista il suo caratteristico colore rosa intenso.
Tuttavia, in condizioni senza specificare il KNODue reagisce con le proteine della carne dando origine a nitrosammine, che possono diventare cancerogene.
D'altra parte, il KNODue (sebbene preferibilmente NaNODue) è un reagente analitico che può essere utilizzato nella sintesi dei coloranti azoici (la reazione dell'acido nitroso con le ammine aromatiche) e nell'analisi degli amminoacidi.
Antidoto
Sebbene abbia i suoi effetti negativi, il KNODue agisce come antidoto nei pazienti avvelenati con cianuri e idrogeno solforato. Il suo meccanismo consiste nell'ossidare i centri FeDue+ alla fede3+ dei gruppi abbiamo le emoglobine, che producono metaemoglobina, che poi reagisce con gli anioni CN- e HS-.
Medici
Nel succo gastrico dello stomaco l'anione NODue- è ridotto a NO, che è noto per avere un'azione vasodilatatrice, aumentando il flusso sanguigno. In altre regioni del corpo dove il pH non è abbastanza acido, alcuni enzimi, come la xantina ossidoreduttasi, sono responsabili della riduzione di NODue-.
È stato utilizzato KNODue per trattare disturbi e malattie come l'angina pectoris e l'epilessia (con effetti collaterali molto negativi).
Riferimenti
- Wikipedia. (2019). Nitrito di potassio. Estratto da: en.wikipedia.org
- PrebChem. (2016). Preparazione del nitrito di potassio. Estratto da: prepchem.com
- Mark Gilchrist, Angela C. Shore, Nigel Benjamin. (2011). Nitrati e nitriti inorganici e controllo della pressione sanguigna, Cardiovascular Research, Volume 89, Issue 3, 15 February 2011, Pages 492-498, doi.org/10.1093/cvr/cvq309
- PubChem. (2019). Nitrito di potassio. Estratto da: pubchem.ncbi.nlm.nih.gov
- Formulazione chimica. (2018). Nitrito di potassio. Estratto da: formulacionquimica.com
- Centro nazionale per il progresso delle scienze traslazionali. (2011). Nitrito di potassio. Estratto da: drug.ncats.io
- Richard J. Epley, Paul B. Addis e Joseph J. Warthesen. (1992). Nitriti nella carne. Università del Minnesota.
- N. R. Rao, B. Prakash e M. Natarajan. (1975). Trasformazioni della struttura cristallina in nitriti, nitrati e carbonati inorganici. Dipartimento di Chimica, Indian Institute of Technology, Kanpur, India.


Nessun utente ha ancora commentato questo articolo.