
Struttura, proprietà, usi, rischi del nitrato di sodio (NaNO3)

Il nitrato di sodio è un solido inorganico cristallino formato da uno ione sodio Na+ e uno ione nitrato NO3-. La sua formula chimica è NaNO3. In natura si trova come il minerale nitratina o nitratite, che si trova in abbondanza nel deserto di Atacama in Cile, motivo per cui questo minerale è anche chiamato salnitro cileno o caliche.
Il nitrato di sodio è un solido non combustibile ma può accelerare l'ossidazione o la combustione di materiali infiammabili. Per questo motivo è ampiamente utilizzato in fuochi d'artificio, esplosivi, fiammiferi, mattoni di carbone e alcuni tipi di pesticidi, per uccidere roditori e altri piccoli mammiferi..

La capacità di favorire la combustione o l'accensione di altri materiali significa che deve essere maneggiato con grande cautela. Se esposto a fiamme o fuoco può esplodere. Nonostante questo il NaNO3 Viene utilizzato nell'industria alimentare in quanto ha proprietà conservanti, soprattutto per le carni e alcuni tipi di formaggi..
Tuttavia, la sua ingestione in eccesso può causare problemi di salute, soprattutto nelle donne in gravidanza, neonati e bambini. Trasformandosi in nitriti nel sistema digerente, può causare alcune malattie.
Indice articolo
- 1 Struttura chimica
- 2 Nomenclatura
- 3 Proprietà
- 3.1 Stato fisico
- 3.2 Peso molecolare
- 3.3 Punto di fusione
- 3.4 Punto di ebollizione
- 3.5 Densità
- 3.6 Solubilità
- 3,7 pH
- 3.8 Altre proprietà
- 4 Ottenimento
- 4.1 Presenza nel corpo umano
- 5 Usi
- 5.1 Nell'industria alimentare
- 5.2 Nei fertilizzanti
- 5.3 Come promotore o facilitatore di combustione o esplosione
- 5.4 Per eliminare roditori e altri mammiferi
- 5.5 Nella preparazione di altri composti
- 5.6 Nell'estrazione di metalli da rifiuti elettronici
- 5.7 Nella ricerca sulla salute e sull'esercizio fisico
- 5.8 In vari usi
- 6 Rischi
- 6.1 Pericoli di manipolazione
- 6.2 Problemi legati alla sua ingestione con cibo o acqua
- 7 Nitrato di sodio negli alimenti
- 8 Riferimenti
Struttura chimica
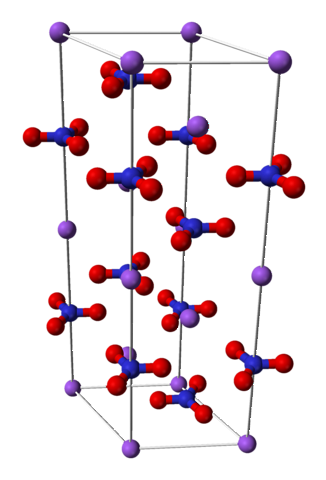
Il nitrato di sodio è costituito da un catione di sodio Na+ e un anione nitrato NO3-.
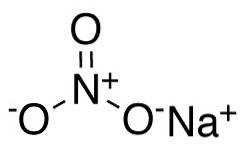
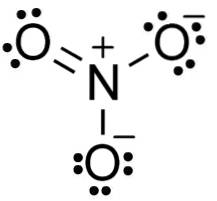
Nell'anione nitrato NO3- l'azoto N ha una valenza di +5 e l'ossigeno una valenza di -2. Per questo motivo l'anione nitrato ha una carica negativa..
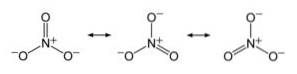
Anione NO3- ha una struttura piatta e simmetrica, in cui i tre ossigeni distribuiscono la carica negativa in modo uguale o uniforme.
Nomenclatura
-Nitrato di sodio
-Nitrato di sodio
-Salnitro di sodio (dall'inglese salnitro di sodio)
-Nitro soda (dall'inglese nitro di soda)
-Salnitro del Cile
-Nitrato dal Cile
-Nitratina
-Nitratite
-Caliche
Proprietà

Stato fisico
Cristalli da incolori a bianchi solidi, trigonali o romboedrici.
Peso molecolare
84,995 g / mol
Punto di fusione
308 ºC
Punto di ebollizione
380 ºC (si decompone).
Densità
2.257 g / cm3 a 20 ºC.
Solubilità
Solubile in acqua: 91,2 g / 100 g di acqua a 25 ºC o 1 g in 1,1 mL di acqua. Leggermente solubile in etanolo e metanolo.
pH
Le soluzioni di nitrato di sodio sono neutre, cioè né acide né basiche, quindi il loro pH è 7.
Altre proprietà
È un solido igroscopico, cioè assorbe l'acqua dall'ambiente.

La sua dissoluzione in acqua fa raffreddare la soluzione, quindi si dice che questo processo di dissoluzione sia endotermico, ovvero quando si dissolve assorbe calore dall'ambiente ed è per questo che la soluzione si raffredda.
A temperature molto basse il nitrato di sodio è solubile in ammoniaca liquida NH3, formando NaNO34NH3 inferiore a -42 ºC.
Nano3 Non è combustibile, ma la sua presenza accelera la combustione di materiali o composti che lo sono. Questo perché quando riscaldato produce ossigeno ODue, tra gli altri gas.
Ottenere
Si ottiene principalmente per estrazione da giacimenti minerari o miniere di salnitro in Cile (caliche o nitratite). Per questo, viene utilizzata la salamoia e quindi viene eseguita la cristallizzazione e la ricristallizzazione per ottenere cristalli di NaNO.3 più puro.
Queste miniere si trovano principalmente in Sud America, nel nord del Cile, nel deserto di Atacama. Lì è associato al nitrato di potassio KNO3 e decomposizione della materia organica.
Può anche essere ottenuto facendo reagire acido nitrico con carbonato di sodio NaDueCO3 o con idrossido di sodio NaOH:
2 HNO3 + N / ADueCO3 → 2 NaNO3 + CODue↑ + HDueO
Presenza nell'organismo umano
Il nitrato di sodio può entrare nel corpo umano attraverso il cibo e l'acqua potabile che lo contiene..
Il 60-80% dei nitrati ingeriti proviene da frutta e verdura. Una seconda fonte sono i salumi. Viene utilizzato dall'industria della carne per prevenire la crescita di microbi e per mantenere il colore.
Tuttavia, un'elevata percentuale di nitrati presenti nel corpo umano proviene dalla sua sintesi endogena o da processi all'interno del corpo..
Applicazioni
Nell'industria alimentare
È usato come conservante negli alimenti, come agente di stagionatura per carni in salamoia e come agente di ritenzione del colore per le carni. Gli alimenti che possono contenerlo sono pancetta, salsicce, prosciutto e alcuni formaggi.

Nei fertilizzanti
Il nitrato di sodio viene utilizzato nelle miscele di fertilizzanti, per fertilizzare le colture di tabacco, cotone e ortaggi.

Come promotore o promotore di combustione o esplosione
Nano3 è usato come ossidante in molte applicazioni. È un solido ricco di ossigeno che facilita il processo di accensione producendo ODue.
La presenza di NaNO3 rende i materiali non richiedono ossigeno da fonti esterne per accendersi poiché fornisce abbastanza ODue per quanto riguarda le reazioni esotermiche (che generano calore) che si autosostengono durante l'accensione o l'esplosione.
È stato a lungo utilizzato come ossidante principale nei materiali pirotecnici (fuochi d'artificio), come componente ossidante negli esplosivi e negli agenti di detonazione o esplosione e come propellente.

Viene anche utilizzato per migliorare la combustione dei mattoni di carbone (bricchetti), per favorire l'accensione dei fiammiferi e anche per migliorare le proprietà combustibili del tabacco..
Per eliminare roditori e altri mammiferi
È usato per un tipo speciale di pesticida. Le composizioni che lo contengono sono fumiganti pirotecnici che vengono posti e incendiati nelle tane, rilasciando dosi letali di gas tossici.
Per questo viene utilizzato per il controllo di vari roditori, marmotte, coyote e moffette, in pieno campo, prati, incolti, prati e campi da golf..
Nella preparazione di altri composti
Utilizzato nella produzione di acido nitrico HNO3, nitrito di sodio NaNODue, e funge anche da catalizzatore nella preparazione dell'acido solforico HDueSW4.
È utilizzato nella produzione di protossido di azoto NDueOppure e come agente ossidante nella produzione di composti farmaceutici.
Nell'estrazione di metalli dai rifiuti elettronici
Alcuni ricercatori hanno scoperto che NaNO3 facilita l'estrazione non inquinante dei metalli contenuti nei rifiuti di apparecchiature elettroniche (cellulari, tablet, computer, ecc.).
Metalli utili che possono essere estratti dai componenti di queste apparecchiature elettroniche sono Nickel Ni, Cobalto Co, Manganese Mn, Zinco Zn, Rame Cu e Alluminio Al.
L'estrazione viene eseguita utilizzando solo una soluzione NaNO3 e un polimero. E si ottiene una resa del 60%.
In questo modo, i rifiuti elettronici possono essere riciclati, contribuendo alla minimizzazione dei rifiuti e al recupero stabile delle risorse..
Nella ricerca sulla salute e sull'esercizio fisico
Secondo alcuni studi l'ingestione di integratori NaNO3 o gli alimenti che lo contengono naturalmente hanno effetti positivi sulla salute. Alcuni degli alimenti ricchi di nitrati sono barbabietole, spinaci e rucola.
Gli effetti includono il miglioramento del sistema cardiovascolare, l'abbassamento della pressione sanguigna, il miglioramento del flusso sanguigno e l'aumento della quantità di ossigeno nei tessuti che si stanno esercitando fisicamente..
Ciò indica che potrebbe essere preso in considerazione l'uso di NaNO.3 come farmaco a basso costo nella prevenzione e nel trattamento di pazienti con problemi di pressione sanguigna.
Inoltre, può servire come un aiuto efficace e naturale per aumentare la potenza muscolare negli atleti.
In vari usi

È usato come agente ossidante e fondente nella produzione di smalti per vetro e ceramica. Viene anche utilizzato in cementi speciali.
Serve come agente chimico nel recupero dello stagno da rottami metallici, nella coagulazione del lattice, nell'industria nucleare e nel controllo della corrosione nei sistemi acquosi.
Rischi
Pericoli di manipolazione
Ha la proprietà di accelerare la combustione di materiali infiammabili. Se si è coinvolti in un incendio, potrebbe verificarsi un'esplosione.
Se esposto al calore o al fuoco per periodi prolungati, può esplodere, producendo ossidi di azoto tossici..
Problemi legati alla sua ingestione con cibo o acqua
I nitrati se ingeriti possono diventare nitriti sia nella bocca che nello stomaco e nell'intestino..
I nitriti, quando reagiscono con le ammine presenti in alcuni alimenti, possono diventare nitrosammine in un ambiente acido come nello stomaco. Le nitrosammine sono cancerogene.
Tuttavia, questo non si verifica quando frutta e verdura che contengono nitrati vengono consumate naturalmente..
Secondo alcuni studi, la presenza di alti livelli di nitrati può produrre una malattia del sangue che fa sì che l'ossigeno non possa essere rilasciato efficacemente nei tessuti.
Ciò può verificarsi nei bambini la cui formula di latte è composta da acqua di pozzo che contiene nitrati..
È stato anche osservato che alti livelli di nitrati possono causare problemi nella gestazione dei bambini, provocando aborti spontanei, nascite premature o difetti nel tubo neurale del feto.
Recentemente è stato scoperto che il nitrato di sodio può rappresentare un rischio per lo sviluppo del sistema muscolo-scheletrico e la comunicazione nervo-muscolo è influenzata nell'uomo.
Nitrato di sodio negli alimenti

Il nitrato di sodio è sinonimo di carni, perché insieme al nitrito, vengono aggiunte ad esse per conservarle e migliorarne l'aspetto e i sapori. Per la sua causa, il consumo eccessivo di carni (hot dog, pancetta, prosciutto, pesce affumicato, ecc.) È stato coinvolto nel collegamento disturbante dei tumori in tutto il sistema digerente.
Sebbene la relazione tra le carni trattate con sali di nitrato-nitrito e il cancro non sia assoluta, si consiglia di moderarne l'assunzione.
Le verdure invece (carote, barbabietole, ravanelli, lattuga, spinaci, ecc.) Sono ricche di NaNO3 poiché lo hanno assorbito dai terreni delle colture per la sua azione fertilizzante. L'assunzione di queste verdure, contrariamente ai prodotti a base di carne, non è legata alle suddette malattie.
Ciò è dovuto a due ragioni: la differenza nei livelli proteici di tali alimenti e il modo in cui vengono cotti. Quando le carni vengono fritte o riscaldate alla fiamma, viene promossa la reazione tra nitrati-nitriti con alcuni gruppi di amminoacidi, per produrre così le nitrosoamine: i veri cancerogeni.
Il contenuto di vitamina C, fibre e polifenoli nelle verdure riduce la formazione di queste nitrosoammine. Ecco perché NaNO3 da solo non è una minaccia per il cibo.
Riferimenti
- NOI. Biblioteca nazionale di medicina. (2019). Nitrato di sodio. Estratto da: pubchem.ncbi.nlm.nih.gov.
- Enciclopedia della chimica industriale di Ullmann. (1990). Quinta edizione. VCH Verlagsgesellschaft mbH.
- Pouretedal, H.R. e Ravanbod, M. (2015). Studio cinetico di Mg / NaNO3 pirotecnico con tecnica TG / DSC non isotermica. J Therm Anal Calorim (2015) 119: 2281-2288. Recuperato da link.springer.com.
- Jarosz, J. et al. (2016). Il nitrato di sodio diminuisce il clustering del recettore dell'acetilcolina indotto dall'agrina. BMC Pharmacology and Toxicology (2016) 17:20. Recupero da bmcpharmacoltoxicol.biomedcentral.com.
- Cotton, F. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Prival, M.J. (2003). Cancro. Agenti cancerogeni nella catena alimentare. In Encyclopedia of Food Sciences and Nutrition (seconda edizione). Recupero da sciencedirect.com.
- Zakhodyaeva, Y.A. et al. (2019). Estrazione complessa di metalli in un sistema acquoso bifase a base di poli (ossido di etilene) 1500 e nitrato di sodio. Molecole 2019, 24, 4078. Recupero da mdpi.com.
- Clements, W.T. et al. (2014). Ingestione di nitrati: una revisione degli effetti sulla salute e sulle prestazioni fisiche. Nutrienti 2014, 6, 5224-5264. Recuperato da mdpi.com.



Nessun utente ha ancora commentato questo articolo.