
Struttura, proprietà e usi del nitrato di calcio (Ca (NO3) 2)

Il nitrato di calcio è un sale inorganico terziario la cui formula chimica è Ca (NO3)Due. Dalla sua formula si sa che il suo solido è composto da ioni CaDue+ e no3- in un rapporto 1: 2. Pertanto, è un composto di natura puramente ionica..
Una delle sue proprietà è il suo carattere ossidante, dovuto all'anione nitrato. Non è combustibile, cioè non brucia ad alte temperature. Essendo incombustibile, rappresenta un solido sicuro da maneggiare senza troppe cure; tuttavia, può accelerare l'accensione di materiali combustibili.

Il suo aspetto è costituito da un solido granulare, di colore bianco o grigio chiaro (immagine in alto). Può essere anidro o tetraidrato, Ca (NO3)Due4HDueO. È molto solubile in acqua, metanolo e acetone.
Il nitrato di calcio è stato ampiamente utilizzato come fertilizzante, poiché viaggia facilmente nel terreno umido e viene rapidamente assorbito dalle radici delle piante. Fornisce due elementi importanti per la nutrizione e la crescita delle piante: azoto e calcio.
L'azoto è uno dei tre elementi essenziali per lo sviluppo delle piante (N, P e K), è essenziale nella sintesi delle proteine. Nel frattempo, il calcio è necessario per mantenere la struttura della parete cellulare della pianta. Per questo motivo Ca (NO3)Due molto va ai giardini.
D'altra parte, questo sale ha azioni tossiche, soprattutto per contatto diretto con la pelle e gli occhi, oltre che per inalazione della sua polvere. Inoltre, può essere decomposto riscaldando.
Indice articolo
- 1 Struttura del nitrato di calcio
- 2 Proprietà fisiche e chimiche
- 2.1 Nomi chimici
- 2.2 Formula molecolare
- 2.3 Peso molecolare
- 2.4 Aspetto fisico
- 2.5 Punto di ebollizione
- 2.6 Punto di fusione
- 2.7 Solubilità in acqua
- 2.8 Solubilità in solventi organici
- 2.9 Acidità (pKa)
- 2.10 Densità
- 2.11 Decomposizione
- 2.12 Profilo reattivo
- 3 usi
- 3.1 Agricoltura
- 3.2 Calcestruzzo
- 3.3 Depurazione o trattamento delle acque reflue
- 3.4 Fare impacchi freddi
- 3.5 Coagulazione del lattice
- 3.6 Trasferimento e conservazione del calore
- 4 Forme di domanda
- 5 Riferimenti
Struttura del nitrato di calcio
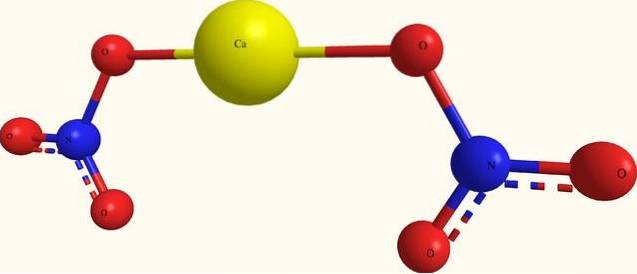
L'immagine in alto mostra la struttura di Ca (NO3)Due in un modello di sfere e barre. Qui però c'è un difetto: si ipotizza l'esistenza di legami Ca-O covalenti, che contraddice il loro carattere ionico. Chiarendo questo, in realtà le interazioni sono di tipo elettrostatico.
Il catione CaDue+ si circonda di due anioni NO3- secondo le sue proporzioni sul vetro. Pertanto, l'azoto predomina sotto forma di nitrato nella struttura cristallina..
Gli ioni sono raggruppati in modo tale da stabilire una configurazione la cui espressione minima è la cella unitaria; che, per il sale anidro, è cubico. Cioè, dai cubi contenenti il rapporto 1: 2 per questi ioni, viene riprodotto l'intero cristallo.
D'altra parte, il sale tetraidrato, Ca (NO3)Due4HDueOppure ha quattro molecole d'acqua per ogni serie NO3- ACDue+ NON3-. Ciò modifica la struttura cristallina, deformandola in una cellula unitaria monoclina..
Pertanto, i cristalli per entrambi i sali anidro e tetraidrato dovrebbero essere diversi; differenze che possono essere determinate nelle loro proprietà fisiche, ad esempio i punti di fusione.
Proprietà fisiche e chimiche
Nomi chimici
-Nitrato di calcio
-Dinitrato di calcio
-Nitrocalcite
-Salnitro norvegese e limesaltpetro.
Formula molecolare
Becco3)Due o CaNDueO6
Peso molecolare
164,088 g / mol anidro e 236,15 g / mol tetraidrato. Notare l'effetto dell'acqua sul peso molecolare e non può essere trascurato quando la si pesa..
Aspetto fisico
Solido o granulato bianco o grigio chiaro. Cristalli bianchi cubici o granuli deliquescenti; cioè, assorbono l'umidità al punto che si dissolvono a causa della loro elevata solubilità.
Punto di ebollizione
La forma anidra si decompone per riscaldamento ad una temperatura che impedisce la determinazione del suo punto di ebollizione; mentre la forma tetraidrata del sale ha un punto di ebollizione di 132ºC (270ºF, 405K).
Punto di fusione
-Forma anidra: da 561 ° C a 760 mmHg (1042 ° F, 834 K).
-Forma tetraidrata: 42,7 ° C (109 ° F, 316 K).
Questo mostra come le molecole d'acqua interferiscono con le interazioni elettrostatiche tra CaDue+ e no3- all'interno dei cristalli; e di conseguenza, il solido fonde a una temperatura molto più bassa.
Solubilità dell'acqua
-Forma anidra: 1212 g / L a 20 ºC.
-Forma tetraidrata: 1290 g / L a 20 ºC.
L'acqua nei cristalli difficilmente aumenta la solubilità del sale.
Solubilità in solventi organici
-In etanolo, 51,42 g / 100 ga 20 ° C.
-In metanolo, 134 g / 100 ga 10 ° C.
-In acetone, 168 g / 100 g a 20 ° C.
Acidità (pKa)
6.0
Densità
2,5 g / cm3 a 25 ºC (tetraidrato).
Decomposizione
Quando il nitrato di calcio viene riscaldato fino all'incandescenza, si decompone in ossido di calcio, ossido di azoto e ossigeno..
Profilo reattivo
È un agente fortemente ossidante, ma non è combustibile. Accelera l'accensione dei materiali combustibili. La divisione del nitrato di calcio in particelle fini, ne facilita l'esplosione quando il composto è esposto a fuoco prolungato.
Le miscele con esteri alchilici diventano esplosive dando origine a esteri di alchil nitrato. La combinazione di nitrato di calcio con fosforo, stagno (II) cloruro o altro agente riducente può reagire in modo esplosivo.
Applicazioni
agricoltura
Viene utilizzato nelle colture come fonte di azoto e calcio. Il nitrato di calcio è molto solubile in acqua e facilmente assorbito dalle radici delle piante. Inoltre, non acidifica i terreni perché i suoi ioni non possono essere idrolizzati in modo significativo..
Evitare la miscelazione con fertilizzanti contenenti fosforo o solfato per evitare la formazione di sali insolubili. A causa della sua igroscopicità, deve essere conservato in un ambiente asciutto e fresco.
Il suo utilizzo ha un vantaggio rispetto all'uso del nitrato di ammonio come fertilizzante. Sebbene quest'ultimo composto apporti azoto alle piante, interferisce con l'assorbimento del calcio, che potrebbe portare a una carenza di calcio nelle piante..
Il calcio contribuisce al mantenimento della struttura della parete cellulare delle piante. In presenza di una carenza di calcio, i tessuti in crescita delle piante, come le punte delle radici, le foglie giovani e le punte dei germogli, mostrano spesso una crescita distorta..
Ammoniaca in diminuzione
Il nitrato di calcio riduce l'accumulo di acidi grassi volatili e composti fenolici, fitotossici che si accumulano a causa della decomposizione dei residui delle colture di soia.
Inoltre, c'è una tendenza per il nitrato di calcio a diminuire la concentrazione di ammonio nel suolo, il che aumenta la capacità di tamponamento dell'idrogeno..
Calcestruzzo
Il nitrato di calcio viene utilizzato per ridurre il tempo di presa del calcestruzzo. Questo è prodotto dalla generazione di idrossido di calcio, forse attraverso una doppia reazione di spostamento..
Inoltre, il nitrato di calcio induce la generazione del composto di idrossido di ferro, la cui azione protettiva sul calcestruzzo ne riduce la corrosione. Cioè, il ferro presente può reagire con i componenti di base del calcestruzzo, come l'idrossido di calcio stesso..
Il nitrato di calcio diminuisce il tempo di presa e la resistenza del calcestruzzo a cui è stata aggiunta la cenere vulcanica. Per studiare l'effetto dell'aggiunta di nitrato di calcio al calcestruzzo, sono state utilizzate concentrazioni crescenti di nitrato di calcio, comprese tra il 2% e il 10%..
È stata osservata una maggiore diminuzione del tempo di presa, nonché un aumento della resistenza del calcestruzzo poiché la concentrazione di nitrato di calcio è aumentata fino al 10%.
Depurazione o trattamento delle acque reflue
Il nitrato di calcio viene utilizzato per ridurre gli odori delle acque reflue riducendo la generazione di idrogeno solforato. Inoltre, la materia organica che genera condizioni anaerobiche viene consumata, il che rende difficile la sopravvivenza di molte specie biologiche..
Fare impacchi freddi
Il nitrato di calcio tetraidrato è un composto endotermico, cioè ha la capacità di assorbire il calore dall'ambiente circostante. Questo produce un raffreddamento dei corpi che entrano in contatto con i contenitori che lo contengono..
Gli impacchi aumentano la loro temperatura, e per rigenerarli è sufficiente metterli in freezer
Coagulazione del lattice
Il nitrato di calcio viene utilizzato nella fase di coagulazione del lattice. Fa parte della soluzione di immersione, e quando viene a contatto con la soluzione contenente il lattice, rompe la sua stabilizzazione e ne provoca la coagulazione..
Trasferimento e conservazione del calore
La miscela binaria di sali di nitrato fuso, compreso il calcio con altri nitrati, viene utilizzata al posto dell'olio diatermico nelle centrali solari per il trasferimento e lo stoccaggio del calore.
Forme di applicazione
-Il nitrato di calcio viene applicato miscelato con il terreno ad una concentrazione di 1,59 kg per 30,48 mDue, con un'adeguata irrigazione. Il nitrato di calcio viene solubilizzato in acqua, permettendone l'assorbimento dalle radici della pianta. Nelle colture idroponiche si dissolve nell'acqua in crescita.
-Il nitrato di calcio viene utilizzato anche sotto forma di spray per nebulizzare foglie e fiori, essendo un trattamento efficace nella prevenzione del marciume del fiore di pomodoro, della macchia di sughero e del nocciolo amaro della mela..
-Alla miscela formante calcestruzzo (cemento, sabbia, pietre e acqua) viene aggiunta una quantità di nitrato di calcio e si determina l'effetto che la sua aggiunta ha sulle proprietà specifiche del calcestruzzo; come l'impostazione di velocità e forza.
-Il nitrato di calcio viene aggiunto a una concentrazione adeguata per ridurre gli odori delle acque reflue o delle acque reflue, a un livello che gli odori siano tollerabili per le persone.
Riferimenti
- Bonnie L. Grant. (2019). Fertilizzante di nitrato di calcio - Cosa fa il nitrato di calcio per le piante. Estratto da: gardeningknowhow.com
- Farquharson, B.F., Vroney, R.P., Beauchamp, E.G. e Vyn, T.J. (1990). L'uso del nitrato di calcio per ridurre l'accumulo di fitotossine durante la decomposizione dei residui corporei. Canadian Journal of Soil Science 70 (4): 723-726.
- Ogunbode, E. B. e Hassan, I.O. (2011). Effetto dell'aggiunta di nitrato di calcio sulle proprietà selettive del calcestruzzo contenente ceneri vulcaniche. Leonardo Electronic Journal of Practices Technologies 19: 29-38.
- Wikipedia. (2019). Nitrato di calcio. Estratto da: en.wikipedia.org
- Shiqi Dong & col. (2018). Inibizione della corrosione dell'acciaio da nitrato di calcio in ambienti fluidi di completamento arricchiti con alogenuri. npj Materials Degradation volume 2, Numero articolo: 32.
- Emaginationz Technologies. (2019). Specifiche del nitrato di calcio. Estratto da: direct2farmer.com
- PubChem. (2019). Nitrato di calcio. Estratto da: pubchem.ncbi.nlm.nih.gov


Nessun utente ha ancora commentato questo articolo.