
Momento di dipolo come viene calcolato ed esempi
Il momento di dipolo è una proprietà chimica che indica in che modo le cariche elettriche sono distribuite in modo eterogeneo in una molecola. È espresso in unità di Debye, 3,33 · 10-30 C · m, e generalmente i suoi valori vanno da 0 a 11 D.
I composti altamente polari tendono ad avere grandi momenti di dipolo; mentre quelle apolari, piccoli momenti di dipolo. Più le cariche elettriche sono polarizzate in una molecola, maggiore è il suo momento di dipolo; cioè, deve esserci una regione ricca di elettroni, δ-, e un'altra povera di elettroni, δ+.

Il momento di dipolo, μ, è una grandezza vettoriale, quindi è influenzato dagli angoli dei legami e, in generale, dalla struttura molecolare.
Quando la molecola è lineare, può essere paragonata a una gomma bicolore. La sua estremità negativa δ-, corrisponderebbe al colore rosso; mentre il positivo, δ +, sarebbe il colore blu. All'aumentare della grandezza delle cariche negative al polo δ e della distanza che lo separa da δ +, il momento di dipolo aumenta.
Chimicamente, questo significa che maggiore è la differenza di elettronegatività tra due atomi e maggiore è la distanza che li separa, maggiore è il momento di dipolo tra di loro..
Indice articolo
- 1 Come viene calcolato il momento di dipolo?
- 2 esempi
- 2.1 Acqua
- 2.2 Metanolo
- 2.3 Ammoniaca
- 2.4 Etanolo
- 2.5 Anidride carbonica
- 2.6 Metano
- 3 Riferimenti
Come si calcola il momento di dipolo?
È considerato un legame covalente tra due atomi, A e B:
A-B
La distanza tra le cariche parziali positive e negative è già definita dalla lunghezza del loro legame:
PERδ+-Bδ-
Perché protoni ed elettroni hanno la stessa grandezza di carica elettrica ma con segni opposti, 1,6 · 10-19C, questo è quello preso in considerazione quando si valuta il momento di dipolo tra A e B utilizzando la seguente equazione:
μ = δd
Dove μ è il momento di dipolo, δ è la carica dell'elettrone senza segno negativo, e d la lunghezza del collegamento espressa in metri. Ad esempio, supponendo che d ha un valore di 2 Å (1 10-10m) il momento di dipolo, μA-B sarà:
μA-B = (1,6 10-19C) · (2 · 10-10m)
= 3,210-29Cm
Ma poiché questo valore è molto piccolo, viene utilizzata l'unità Debye:
μ = (3.210-29C · m) · (1 D / 3,33 · 10-30 Cm)
= 9,60 D
Questo valore di μA-B potrebbe far supporre che il legame A-B sia più ionico che covalente.
Esempi
acqua
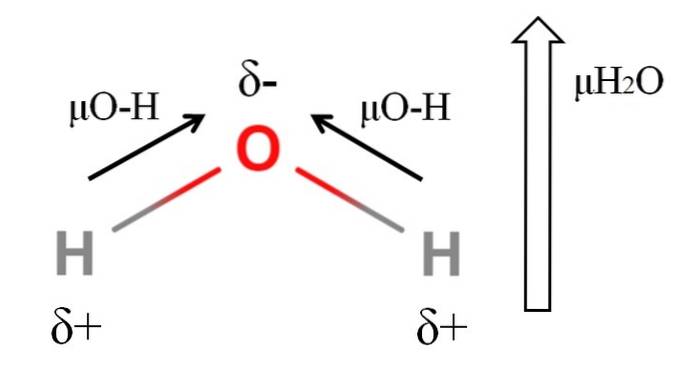
Per calcolare il momento di dipolo di una molecola, tutti i momenti di dipolo dei rispettivi legami devono essere sommati vettorialmente, considerando gli angoli di legame e un po 'di trigonometria. Questo all'inizio.
L'acqua ha uno dei più grandi momenti di dipolo che ci si potrebbe aspettare da un composto covalente. Nell'immagine in alto abbiamo che gli atomi di idrogeno hanno cariche parziali positive, δ +, mentre l'ossigeno trasporta una carica parziale negativa, δ-. Il legame O-H è piuttosto polare (1,5 D) e ce ne sono due in una molecola H.DueO.
Di solito viene disegnato un vettore diretto dall'atomo meno elettronegativo (H) a quello più elettronegativo (O). Sebbene non siano disegnati, sull'atomo di ossigeno ci sono due coppie di elettroni non condivisi, che "concentrano" ulteriormente la regione negativa..
A causa della geometria angolare dell'HDueOppure, i momenti di dipolo si sommano nella direzione dell'atomo di ossigeno. Si noti che la somma dei due μO-H darebbe 3D (1,5 + 1,5); ma non è così. Il momento di dipolo dell'acqua ha un valore sperimentale di 1,85D. L'effetto dell'angolo vicino a 105º tra i legami H-O-H è mostrato qui..
Metanolo
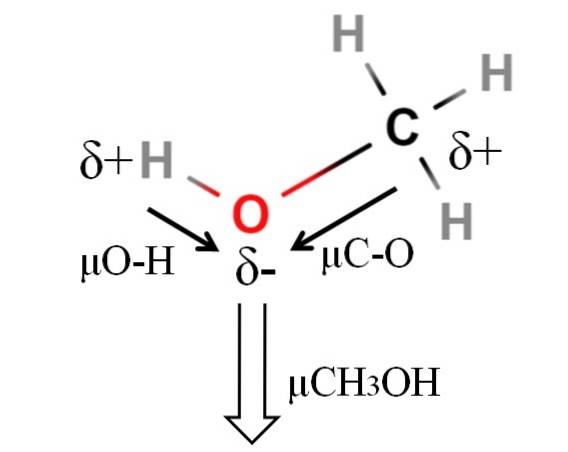
Il momento di dipolo del metanolo è 1,69D. È inferiore a quello dell'acqua. Pertanto, le masse atomiche non hanno molta influenza sul momento di dipolo; ma i loro raggi atomici lo sono. Nel caso del metanolo, non possiamo affermare che il suo legame H-O abbia un μ uguale a 1.5D; da allora, gli ambienti molecolari sono diversi in CH3OH e HDueO.
Questo è il motivo per cui la lunghezza del legame H-O nel metanolo dovrebbe essere misurata per calcolare μO-H. Ciò che si può dire è che μO-H è maggiore di μC-O, poiché la differenza di elettronegatività tra carbonio e ossigeno è inferiore a quella tra idrogeno e ossigeno..
Il metanolo è elencato come uno dei solventi più polari che si possono trovare insieme all'acqua e all'ammoniaca..
Ammoniaca
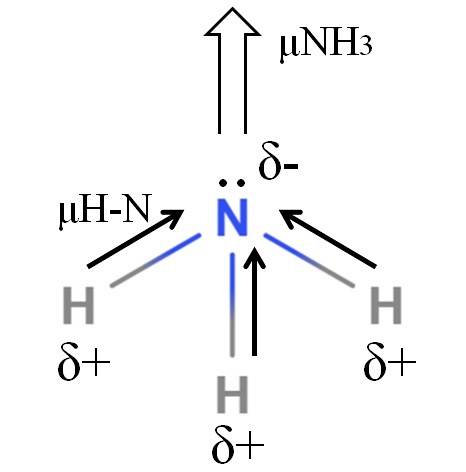
I legami H-N sono piuttosto polari, quindi l'azoto, a causa della sua maggiore elettronegatività, attrae gli elettroni verso se stesso (immagine in alto). Oltre a questo, su di esso abbiamo una coppia di elettroni non condivisi, che contribuiscono con le loro cariche negative alla regione δ. Pertanto, le cariche elettriche predominano sull'atomo di azoto dell'ammoniaca..
L'ammoniaca ha un momento di dipolo di 1,42D, inferiore a quello del metanolo. Se sia l'ammoniaca che il metanolo potessero essere trasformati in correnti d'aria, si vedrebbe che la corrente di metanolo ha poli più definiti rispetto alla corrente di ammoniaca.
Etanolo
Nel caso dell'etanolo, CH3CHDueOH, il suo momento di dipolo è molto vicino a quello del metanolo, ma tende ad avere valori inferiori. Poiché ci sono più atomi di carbonio che compongono la regione δ +, l'atomo di ossigeno che rappresenta δ- inizia a perdere un po 'della sua "intensità relativa negativa".
Diossido di carbonio
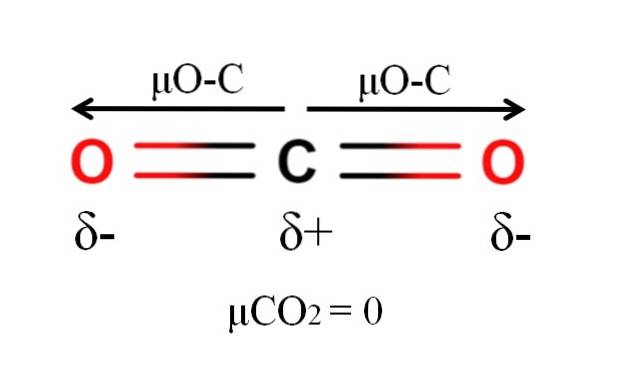
L'anidride carbonica ha due legami polari, C = O, con i rispettivi momenti di dipolo μO-C. Tuttavia, come si può vedere nell'immagine sopra, la geometria lineare di CODue fa sì che i due μO-C si annullino a vicenda in modo vettoriale, anche quando il carbonio ha una carica parziale positiva e gli ossigeni hanno cariche parziali negative.
Per questo motivo l'anidride carbonica è una molecola apolare, poiché μCODue ha un valore di 0D.
Metano
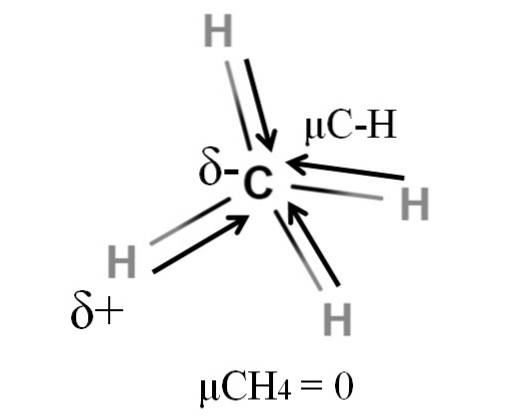
Sia il metano che l'anidride carbonica hanno qualcosa in comune: sono molecole altamente simmetriche. In generale, più una molecola è simmetrica, minore è il suo momento di dipolo..
Se vediamo la molecola CH4, i suoi legami C-H sono polari e gli elettroni sono diretti verso l'atomo di carbonio perché è leggermente più elettronegativo. Si potrebbe pensare che il carbonio debba essere una regione δ altamente negativa; come una gomma da cancellare con il centro rosso intenso e le estremità bluastre.
Tuttavia, dividendo il CH4 a metà avremmo due metà H-C-H, una a sinistra e l'altra a destra, simili alla molecola HDueO. Quindi, il momento di dipolo risultante dall'aggiunta di questi due μC-H si annullerebbe con quello dell'altra metà. E quindi, μCH4 ha un valore di 0D.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). CENGAGE Apprendimento.
- Walter J. Moore. (1963). Chimica fisica. Nella cinetica chimica. Quarta edizione, Longmans.
- Ira N. Levine. (2009). Principi di fisicochimica. Sesta edizione, pp. 479-540. Mc Graw Hill.
- Helmenstine, Anne Marie, Ph.D. (29 gennaio 2020). Definizione del momento dipolare. Estratto da: thoughtco.com
- Blaber Mike. (29 settembre 2019). Momenti di dipolo. Chemistry LibreTexts. Recupero da: chem.libretexts.org
- LaRita Williams. (2020). Momento dipolare: definizione, equazione ed esempi. Studia. Estratto da: study.com
- Wikipedia. (2020). Momento di dipolo di legame. Estratto da: en.wikipedia.org

Nessun utente ha ancora commentato questo articolo.